
【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
【答案】B
【解析】
X、Y、Z、W为短周期主族元素,且Z与W同族,所以二者原子序数相差8,又因为W的原子序数是Z的2倍,所以计算可得W-Z=8,W=2Z,解得W的原子序数为16,W为S。Z的原子序数为8,则Z为O。X、Y分别为C、N。
A.Y与Z分别形成的简单离子电子层数相同,电子层数相同的离子,核电荷数越多,半径越小,故简单离子半径:Y>Z,故A错误;
B.Y元素的最高价氧化物对应的水化物为HNO3,X单质为C,C单质可以和浓硝酸在加热的条件下反应,反应方程式:C+4HNO3(浓) ![]() 4NO2↑+CO2↑+2H2O,故B正确;
4NO2↑+CO2↑+2H2O,故B正确;
C.Z的氢化物为H2O或H2O2;X为C元素,可与H形成许多烃类化合物,如果碳原子数较多,分子量大的烃的沸点就有可能高于Z的氢化物的沸点,故C错误;
D.过氧化氢是一种强氧化剂,漂白原理为氧化性漂白;WZ2为SO2,SO2漂白性的实质是SO2与有机色素结合成了不稳定的无色化合物,该化合物见光、遇热或长久放置又能恢复为原来的颜色,属于非氧化性漂白,二者漂白原理不同,故D错误;
答案为B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热。
(1)已知在298K时下述反应的有关数据:C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示。
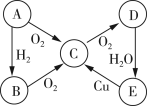
(1)如果A是淡黄色固体,回答下列问题。
①写出A、E的化学式:A________、E________。
②C→D的化学方程式为____________。
③将足量的物质C通入BaCl2溶液中,下列说法正确的是________(填字母序号)。
a.溶液中出现白色沉淀
b.溶液没有明显变化
c.若继续通入Cl2或NH3,则溶液中均出现白色沉淀
(2)如果A是无色气体,回答下列问题。
①D→E的化学方程式为_______。
②E→C的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据水溶液中离子平衡原理回答下列问题:
I.明矾的化学式为____,明矾可用作净水剂,用离子方程式表示明矾的净水原理____
II.常温下有浓度均为0.01mol/L的下列溶液①HNO3 ②H2S ③ NaOH ④NH3·H2O ⑤NH4Cl ⑥NH4HSO4 ⑦ NaCl。回答下列问题:
(1)①②③⑤五中溶液中由水电离出的H+的浓度由大到小的顺序为______(用序号表示,下同)
(2)④⑤⑥三种溶液中NH4+浓度由大到小的顺序为__________________;
(3)①③④⑤⑥⑦六种溶液pH由大到小的顺序为_________________;
(4)等体积的③④分别与同浓度的盐酸反应至均呈中性,消耗盐酸的体积③_____④(填“大于”、“小于”、或“等于”)
(5)10mL ③与20mL⑤混合后,溶液呈_____性(填“酸”、“碱”或“中”),混合溶液中离子浓度由大到小的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. lmol单质Fe与足量的高温水蒸气反应,失去3NA个电子
B. 27g铝中加入1L 1 mol/L的NaOH溶液,转移电子数是3NA
C. 50mll2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常涉及到一些重要的中学化学反应,以下有关叙述正确的是
A.工业上,用焦炭在高温下还原二氧化硅制得粗硅
B.通常将氯气通入到饱和石灰水中制得大量漂白粉
C.工业制硫酸将SO2氧化成SO3的条件一般选择高温、高压、催化剂
D.钠可把钛、锆、铌、钽等金属从它们的卤化物溶液里还原出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有![]() 、
、![]() 、
、![]() 三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p5。则下列有关比较中正确的是
三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p5。则下列有关比较中正确的是![]()
A. 第一电离能:![]()
B. 简单离子半径:![]()
C. 电负性:![]()
D. 最高价氧化物对应水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是原电池的装置图。请回答:
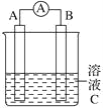
(1)若C为氯化铁溶液,电流表指针发生偏转,A、B电极材料分别为铜和银,则B电极上发生的电极反应式为_______________;
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
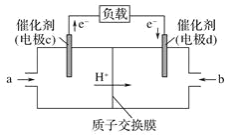
电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_极,电极反应方程式为__。若线路中转移6mol电子,则消耗的O2在标准状况下的体积为____ L。
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)。该蓄电池放电时,电解质溶液中 SO42-移向______(填“正”或“负”)极;正极电极反应方程式为____________;一段时间后,负极增重 48g,转移电子_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素形成的化合物在生产中有重要的用途,请根据信息回答下列问题:
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于____(填“晶体”或“非晶体”)。
(2)黄铜是最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)___Ⅰ1(Cu)(填“>”或“<”) ,原因是____。
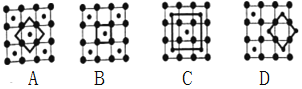
(3)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子),图中用粗线画出的重复结构单元示意图,其中不能描述CoO2的化学组成的是____(填字母)。
(4)在稀氨水中,丁二酮肟(CH3C=N-OH)2与Ni2+反应可生成鲜红色沉淀丁二酮肟镍(结构如图)和H+,常用于检验Ni2+。在丁二酮肟镍中,不存在的作用力有____。
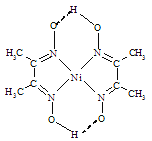
A 配位键 B 离子键 C σ键 D π键 E 金属键 F 氢键
(5)Co3+ 的一种配离子[Co(N3) (NH3)5]2+中,配体有_____,1mol该配离子中所含σ键的数目______。
(6)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____,该立方体中Fe2+间连接起来形成的空间构型是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com