
下列叙述正确的是()
A. 元素的单质可由氧化或还原含该元素的化合物来制得
B. 得电子越多的氧化剂,其氧化性越强
C. 阳离子只能得到电子被还原,只能作氧化剂
D. 含有最高价元素的化合物一定具有强氧化性
考点: 氧化性、还原性强弱的比较.
专题: 氧化还原反应专题.
分析: A.化合物中元素的化合价可能升高也可能降低生成单质;
B.利用得电子的难易程度比较氧化性;
C.处于中间价态的金属阳离子既能作氧化剂又能作还原剂;
D.一般含有最高价元素的化合物具有强氧化性.
解答: 解:A.化合物中元素的化 合价可能升高也可能降低生成单质,如2H2S+SO2═3S↓+2H2O,故A正确;
合价可能升高也可能降低生成单质,如2H2S+SO2═3S↓+2H2O,故A正确;
B.利用得电子的难易程度比较氧化性,得电子数的多少不能判断氧化性的强弱,故B错误;
C.处于中间价态的金属阳离子既能作氧化剂又能作还原剂,如Fe2+既能作氧化剂又能作还原剂,故C错误;
D.一般含有最高价元素的化合物具有强氧化性,如高锰酸钾、硝酸等,但二氧化碳中C为最高价,不具有强氧化性,故D错误;
故选A.
点评: 本题考查氧化还原反应中氧化剂、还原剂等基本概念,明确元素的化合价及离子的性质、物质的性质的关系即可解答,难度不大.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
下列实验所对应的离子方程式正确的是()
A. 向NaAlO2溶液中通入少量CO2:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3﹣
B. 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+
C. 在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO3﹣+2OH﹣═BaCO3↓+CO32﹣+2H2O
D. 向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4﹣═Fe4[Fe(CN)6]2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )
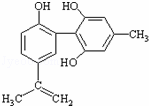
A.该物质遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
将30mL0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液的浓度为()
A. 0.1mol/L B. 0.3mol/L C. 0.05mol/L D. 0.03mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的CuSO4起反应.在该反应中,铁是()
①氧化剂;②还原剂;③被氧化;④被还原.
A. ①③ B. ①④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上部分内容.据此下列说法正确的是()

A. 该试剂的物质的量浓度为9.2 mol•L﹣1
B. 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C. 配制200 mL 4.6 mol•L﹣1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,B为常见金属或非金属单质,有下列转化关系:若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是()
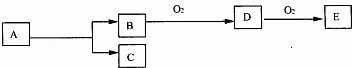
A. AlCl3 B. H2O2 C. KCl D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,AgCl(s)⇌Ag+(aq)+Cl﹣(aq)在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是()

A. 加入AgNO3,可以使溶液由c点变到d点
B. 加入少量水,平衡右移,Cl﹣浓度减小
C. d点没有AgCl沉淀生成
D. c点对应的Ksp等于a点对应的Ksp
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:实验题
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。
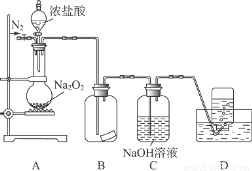
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为:
① ② 。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。

该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出一个要点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com