
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上部分内容.据此下列说法正确的是()

A. 该试剂的物质的量浓度为9.2 mol•L﹣1
B. 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L
C. 配制200 mL 4.6 mol•L﹣1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
考点: 物质的量浓度的相关计算;溶液中溶质的质量分数及相关计算;配制一定物质的量浓度的溶液.
专题: 物质的量浓度和溶解度专题.
分析: A.根据c= 来计算;
来计算;
B.根据Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析;
CuSO4+SO2↑+2H2O及Cu与稀硫酸不反应来分析;
C.根据配制溶液前后溶质的物质的量不变来计算;
D.水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量.
解答: 解:A.由c=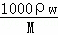 ,c=
,c= =18.4mol/L,故A错误;
=18.4mol/L,故A错误;
B.根据Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O及Cu与稀硫酸可知,随反应的进行,浓硫酸变为稀硫酸,生成二氧化硫的体积小于0.05L×18.4mol/L×0.5×22.4L/mol=10.3L,故B错误;
CuSO4+SO2↑+2H2O及Cu与稀硫酸可知,随反应的进行,浓硫酸变为稀硫酸,生成二氧化硫的体积小于0.05L×18.4mol/L×0.5×22.4L/mol=10.3L,故B错误;
C.根据配制溶液前后溶质的物质的量不变可知,需取该硫酸的体积为 =0.05L=50mL,故C正确;
=0.05L=50mL,故C正确;
D.水的密度比硫酸的密度小,等体积混合时,硫酸的质量大于水的质量,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故D错误;
故选C.
点评: 本题考查物质的量浓度的计算,明确信息利用c=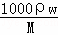 来计算浓度时解答本题的关键,并熟悉溶液配制、稀释计算等,题目难度不大.
来计算浓度时解答本题的关键,并熟悉溶液配制、稀释计算等,题目难度不大.


科目:高中化学 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)⇌CuS(s)+Mn2+(aq),下列说法错误的是()
A. 相同条件下,MnS的Ksp比CuS的Ksp大
B. 该反应的平衡常数K=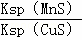
C. 该反应达到平衡时c(Mn2+)=c(Cu2+)
D. 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
1,4﹣环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
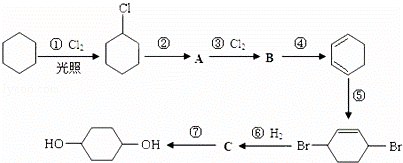
(1)写出反应④、⑦的化学方程式:④ ;
⑦ .
(2)②的反应类型是 ,上述七个反应中属于加成反应的有 (填反应序号).
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B. 盐酸中滴入碳酸钠溶液:CO32﹣+2H+=H2O+CO2↑
C. 盐酸中滴入氢氧化钠溶液:HCl+OH﹣=H2O+Cl﹣
D. 稀硝酸滴在石灰石上:CO32﹣+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 元素的单质可由氧化或还原含该元素的化合物来制得
B. 得电子越多的氧化剂,其氧化性越强
C. 阳离子只能得到电子被还原,只能作氧化剂
D. 含有最高价元素的化合物一定具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式不正确的是()
A. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B. 物质的量相等的溴化亚铁跟氯气反应2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣
C. 向明矾溶液中滴加Ba(OH)2,恰好使SO42﹣沉淀完全:2A13++3SO42﹣+3Ba2++6OH﹣═2A1(OH)3↓+3BaSO4↓
D. 向碳酸钠溶液中滴加过量的稀硫酸:CO32﹣+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤、洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦…
请根据上面叙述,回答:
(1)如图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母).
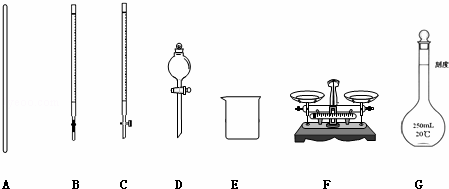
(2)写出步骤③中发生反应的离子方程式 ﹣;.
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是 .
(4)如何确定沉淀是否洗涤干净的操作是 .
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为×100%.(列出算式,不需化简)
(6)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到实验目的.你认为甲学生的观点是否正确?正确(填正确或错误);请说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述正确的是()
A. 0.1mol•L﹣1Na2CO3溶液中:[OH﹣]=[HCO3﹣]+[H+]+[H2CO3]
B. 0.1mol•L﹣1CH3COONa溶液中:[Na+]=[CH3COO﹣]+[OH﹣]
C. CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH)<c (Na2CO3)<c(CH3COONa)
D. 向0.1mol•L﹣1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO﹣]>[Na+]>[OH﹣]=[H+]
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一上期末化学试卷(解析版) 题型:选择题
有 Al2(SO4)3 ,FeSO4,CuCl2, NaOH四种溶液,将其两两反应,若有一种溶液滴入另两种溶液中均产生了白色沉淀,继续滴加该溶液,原白色沉淀或消失或发生颜色变化,则可推断这一种溶液是
A.Al2(SO4)3 B.FeSO4 C.BaCl2 D.NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com