
【题目】(题文)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A. x=0.6a,2Br-+Cl2===Br2+2Cl-
B. x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
C. x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D. x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
【答案】A
【解析】
由于还原性:Fe2+>Br-,通入Cl2,依次发生2Fe2++Cl2=2Fe3++2Cl-,2Br-+Cl2=Br2+2Cl-,当n(Cl2):n(FeBr2)![]() 1/2时,只氧化Fe2+,当n(Cl2):n(FeBr2)
1/2时,只氧化Fe2+,当n(Cl2):n(FeBr2)![]() 3/2时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,结合反应物物质的量之间的关系解答该题
3/2时,Fe2+和Br-被完全氧化,介于二者之间时,Fe2+被完全氧化,Br-被部分氧化,结合反应物物质的量之间的关系解答该题
)A.x=0.6a,n(Cl2):n(FeBr2)介于1/2~3/2,Fe2+被完全氧化,Br-被部分氧化,故A错误;B.x=0.4a,n(Cl2):n(FeBr2)=0.4<1/2,只氧化Fe2+,故B正确;C.x=a,n(Cl2):n(FeBr2)介于1/2~3/2,Fe2+被完全氧化,amolFe2+被氧化消耗0.5amolCl2,剩余0.5amolCl2可与amolBr-发生氧化还原反应,则反应的离子方程式为2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-,故C正确;D.x=1.5a,Fe2+和Br-恰好被完全氧化,反应的离子方程式为2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-,故D正确。答案故选A。


科目:高中化学 来源: 题型:
【题目】下图是以石油为原料的部分转化流程:
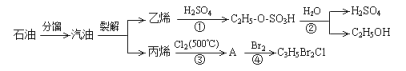
已知:C2H5Br + NaOH ![]() C2H5OH + NaBr (水解反应)
C2H5OH + NaBr (水解反应)
(1)反应①的类型是______________,由乙烯制备乙醇的过程中,硫酸起________作用;
(2)已知A的分子式为C3H5Cl,则A的结构简式为_________________;
(3)C3H5Br2Cl与NaOH溶液完全反应生成有机产物X,则1mol X与足量的Na单质反应可生成标况下____________L氢气;
(4)写出丙烯通入溴的CCl4溶液中发生反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方案能达到实验目的的是( )
A.用盐酸除去镁粉中的少量铝粉
B.用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体
C.用浓硫酸干燥氨气
D.用排水法收集NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的每步转化只需通过一步反应就能实现的是
A. S→SO3→H2SO4→Na2SO3 B. Al→Al (OH)3→Al2O3→Na[Al(OH)4]
C. Na→Na2O2→Na2CO3→NaOH D. Si→SiO2→H2SiO3→Na2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是( )
A. 过氧化钠的化学式: Na2O2
B. Mg2+的结构示意图: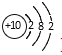
C. 明矾的化学式:Al2(SO4)3
D. 碳酸氢钠的电离方程式:CH3COOH=H+ + CH3COO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为 , ,下列有关说法正确的是
, ,下列有关说法正确的是
A.1 mol该物质与足量淮溴水反应,最多消耗2 molBr2
B.1mol该物质最多能与2mol NaOH反应
C.l mol该物质晟多能与3 mol H2加成
D.该物质的核磁共振氢谱共有6个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。
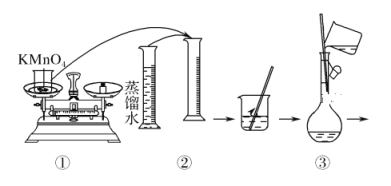
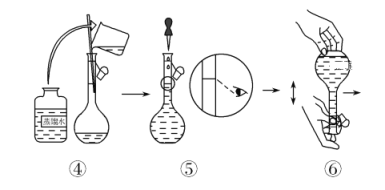
(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X Y M N 反应中的能量变化过程如图,则下列推断一定正确的是( )

A. X 的能量低于 M 的能量
B. Y 的能量低于 N 的能量
C. X 和 Y 总能量低于 M 和 N 总能量
D. 该反应是吸热反应,反应条件是加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com