
 (1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.分析 (1)根据盖斯定律,②×2-①可得目标热化学方程式;
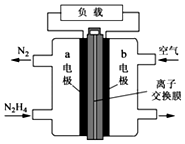
(2)①燃料电池的正极是氧气在正极发生还原反应,是负极发生氧化反应,是肼在反应,注意电解质溶液的酸碱性即可;
②原电池中阴离子移向负极;
③据负极电极反应式计算消耗燃料肼的质量.
(3)结合电极方程式以及两极的变化,判断反应物和生成物,可书写总方程式.
解答 解:(1)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气,将方程式②×2-①得肼和N2H4 反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
(2)①燃料电池的正极是氧气在正极发生还原反应,负极发生氧化反应,是肼在反应,肼中的N从-2价升高到0价,碱性电池中,其电极反应式应为:N2H4+4OH--4e-=N2+4H2O,
故答案为:N2H4+4OH--4e-=N2+4H2O;
②原电池中阴离子移向负极,a为负极,所以电池工作时,OH-移向a电极,故答案为:a;
③负极电极反应式为N2H4+4OH--4e-=4H2O+N2↑,转移4mol电子时消耗肼32g,则转移5mol电子消耗肼32g×$\frac{5}{4}$=40g,故答案为:40;
(3)放电时,负极反应为:LixC6-xe-═6C+xLi+,正极Li1-xCoO2+xLi++xe-=LiCoO2,总电池反应方程式为:Li1-xCoO2+LixC6═6C+LiCoO2,
故答案为:Li1-xCoO2+LixC6═6C+LiCoO2.
点评 本题考查较为综合,为高频考点,侧重于学生的分析、计算能力的考查,题目涉及盖斯定律、电极反应式以及电池反应方程式书写,题目难度较大.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| v正 | v逆 | 平衡常数K | 转化率α |
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
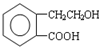 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.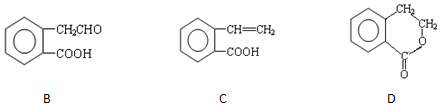
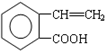 +H2O
+H2O
 .
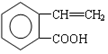
.

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  3-甲基-2-乙基戊烷 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. |  邻甲基苯酚 邻甲基苯酚 | |
| D. | 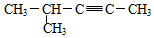 2-甲基-3-戊炔 2-甲基-3-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量时托盘上要垫上干净的称量纸 | |
| B. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 | |
| C. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| D. | 定容摇匀后发现液面下降,不应再加蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com