
分析 (1)氯化铵溶液中铵根离子水解溶液显酸性;
(2)溶液中存在电荷守恒分析判断.
解答 解:(1)NH4Cl溶液中铵根离子水解,溶液显酸性,离子方程式为:NH4++H2O?NH3•H2O+H+,NH4Cl溶液中离子浓度由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸;NH4++H2O?NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)将浓度均为0.10mol/L的CH3COOH溶液和NaOH溶液混合后,溶液中存在电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),若pH>7,溶液显碱性,c(H+)<c(OH-),得到c(Na+)>c(CH3COO-),
故答案为:<.
点评 本题考查了盐类水解原理、电解质溶液中离子浓度大小比较、溶液中电荷守恒的分析应用等知识点,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
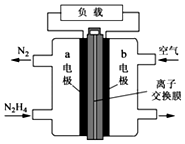 (1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H2>△H3>2△H1 | B. | △H1>△H2>△H3 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△Hl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
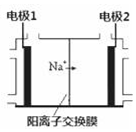 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.其中图2是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息,通电以后,Na+向右侧移动,可判断出电极2 是阴极,在该电极周围的溶液中,NaOH浓度将会变大(填“变大”或“减小”或“不变”);电极1上的电极反应式为2Cl--2e-=Cl2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
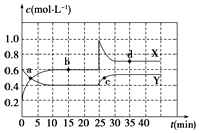
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
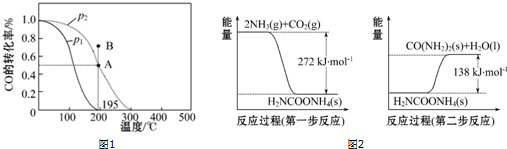
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com