
| A. | 用铂丝蘸取溶液在酒精灯外焰上灼烧,火焰呈黄色,说明原溶液只含有Na+ | |
| B. | 加入盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,原溶液一定存在CO32- | |
| C. | 加入NaOH溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,原溶液中存在NH4+ | |
| D. | 加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,原溶液中一定存在SO42- |
分析 根据常见离子的检验方法进行分析,
A、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳;
B、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀;
C、湿润红色石蕊试纸遇碱性物质变蓝;
D、应通过蓝色钴玻璃观察是否含有K元素.
解答 解:A、钠离子的焰色反应为黄色,钾离子的焰色反应为紫色,会被钠离子的黄色所掩蔽,所以焰色反应为黄色,说明一定含
Na+也可能含K+,故A错误;
B、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳,加入稀盐酸产生无色使澄清石灰水变浑浊的气体,不一定有CO32-,还可能是碳酸氢根,故B错误;
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该气体是氨气,则溶液中一定有NH4+,故C正确;
D、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,存在硫酸根或是银离子中的至少一种,故D错误.故选C.
点评 本题考查离子鉴别题目,做题时注意从题目中找出反应的典型现象,根据物质的性质进行推断.


科目:高中化学 来源: 题型:解答题
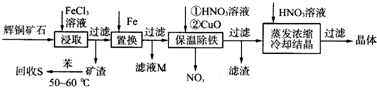
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
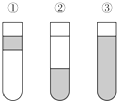 在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,正确的结论是( )
在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示的现象,正确的结论是( )| A. | ①加CCl4 ②加苯 ③加酒清 | B. | ①加酒精 ②加CCl4 ③加苯 | ||
| C. | ①加苯 ②加CCl4 ③加酒精 | D. | ①加苯 ②加酒精 ③加CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)△H<0制备.如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线.回答下列问题:
光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)?COCl2(g)△H<0制备.如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,44g CO2所含的原子数目约为3NA | |
| B. | 2.3g钠在空气中氧化成Na2O转移电子数为0.2NA | |
| C. | 在标准状况时,22.4L CCl4所含的原子数为5NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:$\frac{18}{16}$S | B. | CS2分子的电子式: | ||
| C. | 硫离子(S2-)的结构示意图: | D. | 苯磺酸的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO2与浓盐酸混合加热:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | (NH4)2Fe(SO4)2溶液中加入过量的NaOH溶液:Fe2++2OH-=Fe(OH)2↓ | |
| C. | Ba(HCO3)2溶液中加入稀硫酸:Ba2++SO${\;}_{4}^{2-}$=BaSO4↓ | |
| D. | H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO${\;}_{4}^{-}$+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 强电解质溶液不一定比弱电解质溶液的导电性强 | |
| C. | 盐酸、氢氧化钠、硫酸钡和氧化铝一定是强电解质 | |
| D. | 强、弱电解质的导电性由溶液中溶质的浓度决定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com