
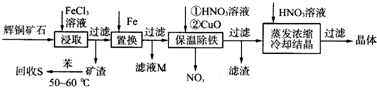
分析 辉铜矿加入氯化铁溶液溶解浸取过滤,得到矿渣加入苯水浴加热回收硫单质;加入在滤液中加入铁还原铁离子和铜离子过滤,滤液M中加入氯气氧化反应生成氯化铁循环使用,保温除铁加入稀硝酸溶液和氧化铜反应,调节溶液PH除去杂质离子,过滤得到滤液为硫酸亚铁溶液,在稀硝酸溶液中蒸发浓缩,冷却结晶过滤洗涤得到晶体;
(1)铁离子做氧化剂被还原为亚铁离子,Cu2S被氧化,生成铜离子和硫单质;
(2)苯沸点比较低,温度过高苯容易挥发,从反应动力学看温度过低溶解速率小;
(3)向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀,加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质.
解答 解:(1)铁离子做氧化剂,Cu2S被氧化,离子方程式为:Cu2S+4Fe3+=2Cu2++4Fe2++S,
故答案为:Cu2S+4Fe3+=2Cu2++4Fe2++S;
(2)苯沸点比较低,温度过高苯容易挥发,从反应动力学看温度过低溶解速率小,
故答案为:苯沸点比较低,温度过高苯容易挥发,从反应动力学看温度过低溶解速率小;
(3)向滤液M中通入Cl2将FeCl2氧化为FeCl3,可以循环使用,故选b,故答案为:b;
(4)Fe3++3H2O?Fe(OH)3+3H+,加入CuO使水解平衡正向进行,调节溶液的PH使铁元素完全转化为氢氧化铁沉淀,加热过程中Cu2+会水解,加入硝酸抑制Cu2+的水解,不引入新的杂质,
故答案为:调节溶液PH使使铁元素完全转化为氢氧化铁沉淀,抑制铜离子水解.
点评 本题考查了物质分离提纯的方法和流程判断,主要是物质性质的理解应用和实验基本操作,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
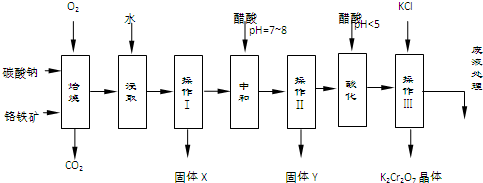
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
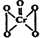 ),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.
),该反应可用来检验Cr2O72-的存在.写出反应的离子方程4H2O2+Cr2O72-+2H+═2CrO5+5H2O.该反应不属于(填“属于”或“不属于”)氧化还原反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH和CH3COOH OH-+H+=H2O | |
| B. | 过量的CO2与NaOH溶液 CO2+2OH-=CO32-+H2O | |
| C. | Ba(OH)2+H2SO4=BaSO4+2H2O Ba2++SO42+=Ba SO4 | |
| D. | NaHS+HCl=NaCl+H2S HS++H+=H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取溶液在酒精灯外焰上灼烧,火焰呈黄色,说明原溶液只含有Na+ | |
| B. | 加入盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,原溶液一定存在CO32- | |
| C. | 加入NaOH溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,原溶液中存在NH4+ | |
| D. | 加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,原溶液中一定存在SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com