
【题目】关于乙酸和乙醇的叙述正确的是
A.都能使石蕊溶液变红
B.分子中原子之间只存在单键
C.都能与钠反应并生成H2
D.都能与NaHCO3反应并生成CO2
科目:高中化学 来源: 题型:
【题目】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,22.4LNO与11.2LO2充分反应后得到的气体分子数为NA
B. 3.6g重水中含有的中子数为2 NA
C. 常温下,1L1mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
D. 一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对于可逆反应:A(?)+3B(?)![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是

A. 若正反应方向△H<0,则T1>T2 B. 压强增大时,混合气体的平均相对分子质量减小
C. A一定为气体 D. B一定为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:
(已知碳酸氢铵受热分解后无固体剩余)
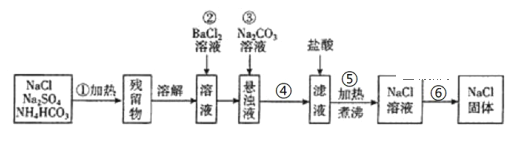
请根据操作流程回答下列问题:
(1)操作①在加热时应选择用_____________来盛装混合物(填仪器名称)。
(2)操作②发生的化学反应方程式为:___________________________________________;
判断SO42-已沉淀完全的方法是______________________________________________。
(3)操作③的目的是___________________________________。
(4)操作④和操作⑥的分离提纯方法的名称分别是____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. lL 1mol/LNa2CO3溶液中,CO32-离子总数为NA
B. 1LpH=2 的新制氯水中,阳离子总数为0.01NA
C. C与浓H2SO4加热生成4.48LCO2气体.转移的电子数为0.4NA.
D. 7.lg37Cl2中含有氯分子0.lNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用基本公式进行计算:
(1)标准状况下,①4g氢气、 ②33.6L甲烷(CH4)、 ③6.02×1024个水分子、④1mol NH3中,
分子数由大到小的顺序为 ____________________(填序号,下同),含氢原子数最多的是_________,体积最大的是____________。
(2)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(混合后体积变化忽略不计),
所得溶液中Cl-的物质的量浓度是_____________________。
(3)已知224L标准状况下的HCl气体完全溶于1L水(密度为1g/cm3)得到密度为1.1g/cm3的盐酸,此盐酸的物质的量浓度为:__________________ (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。
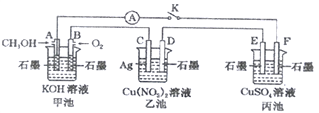
请回答下列问题:
(1)甲池为_________(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为______。
(2)丙池中F电极为____(填“正极”、“负极”、“阴极”或“阳极”),该池总反应的方程式为_____。
(3)当乙池中C极质量减轻4.32g时,甲池中B电极理论上消耗O2的体积为_____mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是______(填字母)。
A.Cu B.CuO C.Cu(OH)2 D.Cu(OH)2CO3
(5)甲醇和乙醇都可以做燃料。已知乙醇液体完全燃烧生成CO2气体和1mol液态水时放出热量453.3kJ,请写出乙醇燃烧的热化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com