
【题目】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。

【答案】 1s22s22p63s23p63d84s2 氧 分子晶体 BC > r(Ni2+)<r(Fe2+),NiO的晶格能大于FeO CN- K4[Fe(CN)6]·3H2O+6H2SO4+3H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑ 邻硝基苯酚形成分子内氢键,降低其在水中的溶解度;对硝基苯酚与水形成分子间氢键,增大了溶解度。 sp3 (Si4O11)n6n-或Si4O116-
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑ 邻硝基苯酚形成分子内氢键,降低其在水中的溶解度;对硝基苯酚与水形成分子间氢键,增大了溶解度。 sp3 (Si4O11)n6n-或Si4O116-
【解析】(1)Ni是28号元素,核外有28个电子,分四层排布,其电子排布式为:1s22s22p63s23p63d84s2或[Ar]3d84s2;Ni有2个未成对电子,第二周期元素未成对电子数为2的元素有C、O,其中电负性大的是O,故答案为:1s22s22p63s23p63d84s2;氧;
(2)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,应为分子晶体,呈正四面体构型,应为非极性分子,易溶于非极性溶剂,故选BC,故答案为:分子晶体;BC;
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,晶格能越大,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>; r(Ni2+)<r(Fe2+),NiO的晶格能大于FeO;
(4)K4[Fe(CN)6]3H2O中CN-为配体;K4[Fe(CN)6].3H2O与硫酸在加热条件下反应生成K2SO4、CO、FeSO4、(NH4)2SO4,则其反应方程式为:K4[Fe(CN)6]·3H2O+6H2SO4+3H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑,故答案为:CN-;K4[Fe(CN)6].3H2O+6H2SO4+3H2O
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑,故答案为:CN-;K4[Fe(CN)6].3H2O+6H2SO4+3H2O![]() 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑;
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑;
(5)形成分子间氢键能增大物质的溶解性,形成分子内氢键,减小物质的溶解性,邻硝基苯酚形成分子内氢键,降低其在水中的溶解度,对硝基苯酚与水形成分子间氢键,增大了溶解度;故答案为:邻硝基苯酚形成分子内氢键,降低其在水中的溶解度;对硝基苯酚与水形成分子间氢键,增大了溶解度;
(6)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图(b)可知一个重复的结构单元为:![]() ,其中含有硅原子数为2+4×
,其中含有硅原子数为2+4×![]() =4,氧原子数为8+6×
=4,氧原子数为8+6×![]() =11,根据正负化合价的代数和为电荷数可知,该离子带6个单位的负电荷,离子符号为Si4O116-,故答案为:sp3;Si4O116-。
=11,根据正负化合价的代数和为电荷数可知,该离子带6个单位的负电荷,离子符号为Si4O116-,故答案为:sp3;Si4O116-。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】五氯化磷(PCl5)常温下是一种淡黄色固体,在潮湿空气中水解产生两种酸。PCl5在有机合成中被广泛用作氯化剂、催化剂、脱水剂等,高纯度PCl5主要用于医药中间体及锂电池原材料的合成。工业生产PCl5的传统方法是在搅拌式反应釜中注入液体三氯化磷(PCl3),再通入氯气在合适的温度下发生反应:PCl3+Cl2![]() PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。
PCl5。某工厂对传统方法进行了改进以生产高纯度PCl5,主要流程如下图所示(循环水的作用是控制温度)。

请回答下列相关问题。
(1)工业生产氯气的主要方法的离子方程式是___________,利用该反应所得产品可继续生产_________(任写一种)等化工产品。
(2)浓硫酸吸收罐和硫酸镁吸收塔的作用是______________________,若去掉这两个设备夹套反应釜中发生的主要副反应是______________________________。
(3)夹套反应釜中的原料混合方式与搅拌式反应釜相比主要优点是____________________________。 (4)NaOH水池的作用是_______________________,从降低生产成本的角度考虑NaOH溶液可更换为______。
(5)生产过程中PCl3的加料速率会对生产造成明显的影响,具体情况如下表。根据表中数据判断最佳的加料速率范围是_________________kg·h-1。
PCl3加料速率/kg·h-1 | PCl5状态 | 热交换情况 | 生产500kg产品的周期/h |
40 | 致密、坚硬、造粒困难 | 快、温度可控 | 11.5 |
50 | 致密、坚硬、造粒困难 | 快、温度可控 | 9.2 |
60 | 较松散、造粒容易 | 较快、温度可控 | 7.2 |
70 | 松散、造粒容易 | 较快、温度可控 | 6.5 |
80 | 松散、造粒容易 | 慢、温度升高难以控制 | 5.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q、r,t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一;25℃时,0.01mol·L-1的v溶液中:c(OH-)/c(H+)=1.0×1010。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小:W>Z>Y>X
B. Z分别与Y、W组成的化合物中化学键类型可能相同
C. v能抑制水的电离而u能促进水的电离
D. 粘有q的试管可用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.氯化钠可用于制备纯碱
B.食品袋中常放有生石灰,能起到抗氧化剂的作用
C.大力发展新能源汽车能减少酸雨危害
D.石油裂化、煤的干馏、玉米制乙醇、蛋白质变性都属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 原电池中发生的反应达到平衡时,该电池无电流产生
C. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),其可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJmol-1,
C(s)+CO2(g)═2CO(g)△H2=+172.5kJmol-1
则CO还原Fe2O3(s)的热化学方程式为__________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图1。
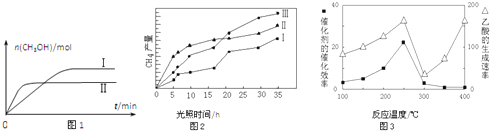
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ__________KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为__________。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、II和III从大到小的顺序为__________(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水中逐滴加入0.1000mol/L的HC1溶液,测得混合溶液的温度变化如图所示。下列相关说法正确的是

A. 已知:25℃时,0.1000mol/L氨水的电离度为1.33%,该氨水的pH约为12
B. 若a点溶液呈碱性,则a点溶液中:c(NH4+)>c(Cl-)>c(NH3H2O)
C. b点溶液pH=7,c点溶液pH<7
D. b点溶液中: 0.1000mol/L +c(OH-)=c(Cl-)- c(NH3H2O)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙酸和乙醇的叙述正确的是
A.都能使石蕊溶液变红
B.分子中原子之间只存在单键
C.都能与钠反应并生成H2
D.都能与NaHCO3反应并生成CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com