【答案】
分析:A、B、C、D都是短周期元素,根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为:
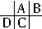
,C原子序数等于A原子序数+8,C原子核内的质子数等于A、B原子核内的质子数之和,故B原子序数为8,故B为氧元素.
C原子最外层电子数是D原子最外层电子数的3倍,若D的最外层电子数为1,则C为铝元素,A为硼元素,D为钠元素;若D的最外层电子数为2,则C为硫元素,A为氧元素,不合题意.
所以A为硼元素,B为氧元素,C为铝元素,D为钠元素.
根据原子结构特点判断元素所在周期表中位置,结合元素周期律的递变规律比较离子半径大小.
解答:解:A、B、C、D都是短周期元素,根据原子半径D>C>A>B,且A、B同周期,A、C同主族,推知A、B、C、D在周期表中的大致相对位置为:
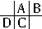
,C原子序数等于A原子序数+8,C原子核内的质子数等于A、B原子核内的质子数之和,故B原子序数为8,故B为氧元素.
C原子最外层电子数是D原子最外层电子数的3倍,若D的最外层电子数为1,则C为铝元素,A为硼元素,D为钠元素;若D的最外层电子数为2,则C为硫元素,A为氧元素,不合题意.
所以A为硼元素,B为氧元素,C为铝元素,D为钠元素.
A、B为氧元素,C为铝元素,D为钠元素,B、C、D三种元素组成的化合物的化学式为NaAlO
2,故A错误;
B、A为硼元素,C为铝元素,最外层电子数都为3,两元素处在元素周期表中的第ⅢA族,故B错误;
C、B、C、D三种元素的简单离子分别为O
2-、Al
3+、Na
+,三种离子核外电子排布相同,核电核数越大,离子半径越小,则有O
2->Na
+>Al
3+,故C错误;
D、B为氧元素,D为钠元素,B、D两元素组成的离子化合物Na
2O、Na
2O
2中阴、阳离子的个数比都为1:2,故D正确.
故选D.
点评:本题考查位置结构性质的相互关系及应用,题目难度中等,注意根据原子的结构特点判断元素的种类,把握离子半径的比较方法.

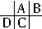 ,C原子序数等于A原子序数+8,C原子核内的质子数等于A、B原子核内的质子数之和,故B原子序数为8,故B为氧元素.
,C原子序数等于A原子序数+8,C原子核内的质子数等于A、B原子核内的质子数之和,故B原子序数为8,故B为氧元素.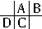 ,C原子序数等于A原子序数+8,C原子核内的质子数等于A、B原子核内的质子数之和,故B原子序数为8,故B为氧元素.
,C原子序数等于A原子序数+8,C原子核内的质子数等于A、B原子核内的质子数之和,故B原子序数为8,故B为氧元素.

 名师点拨卷系列答案
名师点拨卷系列答案


