
科目:高中化学 来源: 题型:

| 700(W2-W1) |
| a |
| 700(W2-W1) |
| a |

| 280cd |
| b |
| 280cd |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
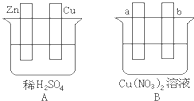 Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银离子 | B、亚铁离子 | C、镁离子 | D、铝离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
除了铝盐之外,铁盐和亚铁盐也可用作净水剂。若向自来水中加入亚铁盐,亚铁离子首先与自来水中残留的氯气发生反应生成铁离子,铁离子发生水解生成带正电荷的氢氧化铁胶体,氢氧化铁胶体吸附带负电荷的胶粒,从而起到净水作用。写出亚铁盐净水过程中发生反应的离子方程式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com