
| A、工业制取漂白粉 |
| B、工业上进行氯碱工业反应 |
| C、工业上利用合成氨实现人工固氮 |
| D、实验室制取Al(OH)3 |
| ||
| 高温高压 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车尾气净化器中的主要反应为:2NO(g)+2CO(g)
汽车尾气净化器中的主要反应为:2NO(g)+2CO(g)| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1 NaOH 溶液:K+、Ba2+、Cl-、HCO3-. |
| B、0.1mol?L-1 Na2CO3 溶液:K+、NH4+、NO3-、SO42- |
| C、0.1mol?L-1 FeCl3溶液:K+、Na+、I-、SCN- |
| D、0.1mol?L-1HCl 溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
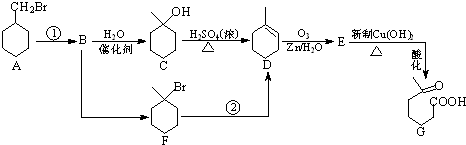
 、且属于酯类的同分异构体:
、且属于酯类的同分异构体:
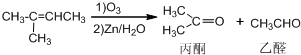
 )也可以发生“Diels-Alder反应”,该化学反应方程式为:
)也可以发生“Diels-Alder反应”,该化学反应方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | CH3OH的体积分数/% |
| 810 | a |
| 915 | 10.0 |
| 1000 | b |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| n |
| m |
| n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com