
| 温度/℃ | CH3OH的体积分数/% |
| 810 | a |
| 915 | 10.0 |
| 1000 | b |
| 1 |
| 2 |
| 3 |
| 2 |
| x |
| 3 |
| x |
| 3 |
| x | ||
6+
|
| 0.643mol/L |
| 3mol/L |
| 0.643×0.643 |
| (3-0.214)×(3-0.643)3 |
| y |
| 6-2y |
| 6b |
| 1+2b |
| 3-y |
| 6-2y |
| 1 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气是黄绿色的,氯离子是无色的 |
| B、氢气在氯气中燃烧时发出苍白色火焰 |
| C、氯气有毒,新制的氯水有漂白性,而氯离子既无毒也无漂白性 |
| D、氢气和氯气的混合气体只有在强光照射下才能迅速化合生成氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Na2O2电子式: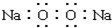 |
B、NH4+的电子式: |
| C、同位素:1H2、2H2、3H2 |
D、如图 表示质量数是204.4的铊元素 81Tl 表示质量数是204.4的铊元素 81Tl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物含0.1molFe |
| B、原混合物的质量可能大于8.8g |
| C、生成物中含0.1molFeS |
| D、加热后的混合物由FeS、Fe组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
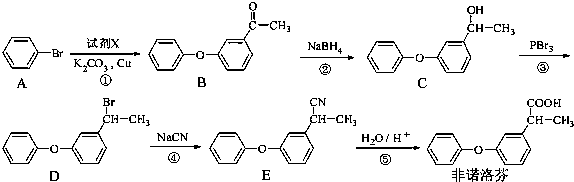
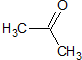 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br| NaOH溶液 |
| △ |
| CH2COOH |
| 浓硫酸,△ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①:制取乙炔并验证炔烃的性质 |
| B、装置②:检验乙醇的氧化性,溶液颜色从绿色变成橙色 |
| C、装置③:验证葡萄糖分子中含有醛基官能团 |
| D、装置④:酸性KMnO4溶液中出现气泡且颜色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com