
向体积为0.5L的
AlCl3溶液中逐
滴加入某
浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果正确的是
 A.反应过程中,沉淀最多时的质量为7.8g
A.反应过程中,沉淀最多时的质量为7.8g
B.AlCl3溶液的浓度为2.0mol/L
C.得到39g沉淀时,消耗的NaOH溶液体积
一定为1.5L
D.当NaOH溶液体积为4.0L时,得到的溶液中Na+、Cl-浓度相等
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |

| 4 |
| a2 |
| 4 |
| a2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省日照市高三12月月考校际联合检测化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A.图甲中曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉,产生H2的物质的量的变化
B.图乙表示将0.10 mol/LNaOH溶液分别滴加到浓度相同的三种一元酸中,由图可知③的酸性最强
C.图丙为水的电离平衡曲线,若从A点到C点,可采用在水中加入适量NaOH固体的方法
D.图丁中曲线表示将pH相同的NH4Cl溶液和稀盐酸稀释相同倍数时,二者pH的变化向容积均为0.5L的
查看答案和解析>>
科目:高中化学 来源:0104 模拟题 题型:填空题
 O2+Hb·CO 实验表明,c(Hb·CO)即使只有c(Hb·O2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol·L-1,若使c(Hb·CO)小于c(Hb·O2)的1/50,则吸入肺部CO的浓度不能超过_________mol·L-1。
O2+Hb·CO 实验表明,c(Hb·CO)即使只有c(Hb·O2)的1/50,也可造成人的智力损伤。已知t℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2mol·L-1,若使c(Hb·CO)小于c(Hb·O2)的1/50,则吸入肺部CO的浓度不能超过_________mol·L-1。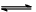 N2(g) + 2CO2(g) △H=-113kJ·mol-1
N2(g) + 2CO2(g) △H=-113kJ·mol-1
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表: 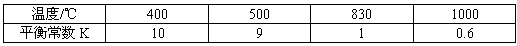
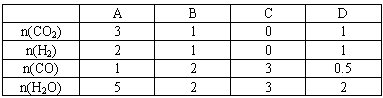
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如右图所示。下列结果正确的是
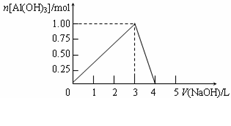 A.反应过程中,沉淀最多时的质量为7.8g
A.反应过程中,沉淀最多时的质量为7.8g
B.AlCl3溶液的浓度为2.0 mol/L
C.得到39g沉淀时,消耗的NaOH溶液体积
一定为1.5 L
D.当V(NaOHaq)=4.0 L时,得到的溶液中
Na+、Cl-浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com