
已知常温下KHSO3溶液的pH<7,且等浓度的HSO3-的电离程度大于SO32-的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是
A.c(SO42-)>c(HSO3-)>c(SO32-) >c(H2SO3)
B.c(K+)>c(SO32-)>c(SO42-)>c(HSO3-)>c(H+)>c(OH-)
C.c(K+)=c(HSO3-)+2c(SO32-)+2c(SO42-)
D.c(K+)+c(H+)=c(HSO3-)+c(SO32-)+c(SO42-)+c(OH-)
科目:高中化学 来源:2013-2014安徽省蚌埠市高三第三次教学质量检查理综化学试卷(解析版) 题型:选择题
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于描述正确的是
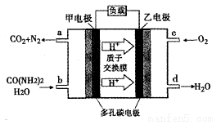
A、电池工作时H+ 移向负极
B、该电池用的电解质溶液是KOH溶液
C、甲电极反应式为:CO(NH2 )2 + H2O - 6e-= CO2 + N 2 + 6H+
D、电池工作时,理论每有净化1mol CO(NH2 )2 ,消耗 33.6 L O2
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省高二(下)期末考试化学试卷(解析版) 题型:填空题
(14分)Q、W、X、Y、Z均为元素周期表中前四周期元素,且其原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是其次外层电子数的2倍,Y是地壳中含量最多的元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
⑴W位于元素周期表第 周期第 族。Y的第一电离能 (填“大于”或“小于”)X的第一电离能。
⑵XQ3分子中的化学键类型为 (填“极性”或“非极性”)共价键,空间类型为 。Q—X﹑Q—Y﹑Q—W中键长最短的是 。
⑶Z的基态原子核外电子排布式是 ,Z的单质与X的最高价氧化物对应水化物的稀溶液反应的离子方程式为 。
⑷已知:①WQ4(g) +4XY2(g) ﹦4XY(g)+WY2 (g)+2Q2Y(g) △H﹦-574KJ·mol-1
②WQ4(g) +4XY(g) ﹦2X2 (g) +WY2 (g) +2Q2Y(g) △H﹦-1160KJ·mol-1
则由WQ4还原XY2生成X2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:填空题
(14分)实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取n g该种氨基酸放在纯氧气中充分燃烧,生成CO2、H2O和N2。现按图所示装置进行实验:

请回答下列有关问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是__________________________。
(2)以上装置中需要加热的仪器有________(用字母填空)。操作时应先点燃________处的酒精灯。
(3)A装置中发生反应的化学方程式是___________________________________。
(4)装置D的作用是___________________________________。
(5)读取N2体积时,应注意:①________________________;②______________________。
(6)实验中测得N2的体积为V mL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据有________(用字母填空)。
A.生成CO2气体的质量 B.生成H2O的质量 C.通入O2的体积D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验: 断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是
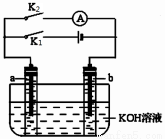
A.断开K2,闭合K1一段时间,溶液的pH变大
B.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-====H2↑
C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-====O2↑+2H2O
D.断开K1,闭合K2时,OH-向b极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
把含有FeBr2、FeI2各a mol的稀溶液两份,分别通入一定量的Cl2,第一份溶液中有一半的I― 被氧化成I2,第二份溶液中有一半的Br― 被氧化成Br2,两份通入Cl2的物质的量之比
A.1:1 B.1:2 C.1:3 D.1:5
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:填空题
(8分)某氮肥厂氨氮废水中氮元素多以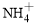 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:

(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用: 。
(2)过程Ⅱ:在微生物作用的条件下,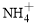 经过两步反应被氧化成
经过两步反应被氧化成 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下:

第一步反应是 反应(选填“放热”或“吸热”),判断依据是
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是( )
A.0.02 mol·L-1·s-1 B.1.8 mol·L-1·s-1 C.1.2 mol·L-1·s-1 D.0.18 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com