
已知:①101kPa时,2C(s)+O2(g) = 2CO(g);△H = -221kJ/mol
②稀溶液中,H+(aq)+OH-(aq) = H2O(l);△H = -57.3kJ/mol
下列说法正确的是
A. 有水生成的反应都是放热反应
B. 稀醋酸与稀 NaOH 溶液反应生成 1mol 水,放出 57.3kJ 热量
C. 24g C 与 1L O2 反应生成 2L CO 时放出 221kJ 热量
D. 碳的燃烧热大于110.5 kJ / mol
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
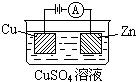
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有水生成的反应都是放热反应 | B、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 | C、24g C与1L O2反应生成2L CO时放出221kJ热量 | D、碳的燃烧热大于110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石比石墨稳定 | B、石墨的热值比9.2kJ?g-1大 | C、所有强酸与强碱反应生成1molH2O时放出的热量都为57.3kJ | D、1mol醋酸与1mol氢氧化钠在稀溶液中完全反应时,放出的热量大于57.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com