
分析 (1)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(2)①根据温度对化学平衡的影响来回答;
②温度对化学平衡常数的影响和反应的吸放热有关;
③化学平衡正向移动可增加甲醇产率;
(3)在甲醇燃料电池中,燃料甲醇作负极,发生失电子的氧化反应,氧气作正极,发生得电子的还原反应,根据电极反应以及电子守恒来计算转移电子的量.
解答 解:(1)a.由方程式可以看出,反应前后气体的物质的量不相等,只有达到平衡状态,容器压强不发生变化,能判断反应达到平衡状态,故a错误;
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等,即正逆反应速率相等,所以能判断反应达到平衡状态,故b错误;
c、一定条件下,CO、H2和CH3OH的浓度保持不变是平衡的标志,故c错误;
d、一定条件下,单位时间内消耗2molCO,同时生成1mol CH3OH,只能表明正反应速率,不能表示正逆反应速率相等,故d正确;
故选d;
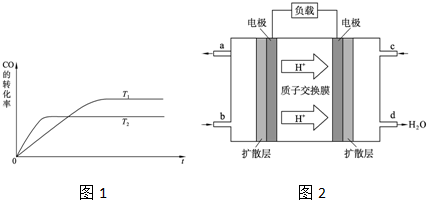
(2)①反应CO(g)+2H2(g)?CH3OH(g)中,反应向右进行,一氧化碳的转化率增大,温度升高,化学平衡向着吸热方向进行,根据图中的信息可以知道:T2>T1,所以该反应是放热反应,<0,故答案为:<;
②对于放热反应,温度越高,化学平衡常数越小,T2>T1,反之越大,所以K1>K2,故答案为:>;
③a、若容器容积不变,升高温度,反应CO(g)+2H2(g)?CH3OH(g)平衡逆向移动,甲醇产率降低,故a错误;
b、将CH3OH(g)从体系中分离,反应CO(g)+2H2(g)?CH3OH(g)平衡正向移动,甲醇产率增大,故b正确;
c、使用合适的催化剂不会引起化学平衡的移动,甲醇的转化率不变,故c错误;
d、若容器容积不变,充入He,使体系总压强增大,单质各组分的浓度不变,化学平衡不移动,甲醇的转化率不变,故d错误;
故选b;
(3)①在甲醇燃料电池中,燃料甲醇作负极,氧气作正极,电解质中的阳离子移向正极,所以b口通入的物质为甲醇,c口通入的物质为氧气,该电池正极是氧气发生得电子的还原反应,电极反应式为:O2+4e-+4H+=2H2O;
故答案为:O2+4e-+4H+=2H2O;
②当0.2mol甲醇完全反应生成CO2时,根据总反应:2CH3OH+3O2=2CO2+4H2O,消耗氧气0.3mol,转移电子1.2mol;
故答案为:1.2NA.
点评 本题是一道关于化学平衡状态的判断、化学平衡的移动以及燃料电池的工作原理知识的考题,要求学生具有分析和解决问题的能力,难度不大.


科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
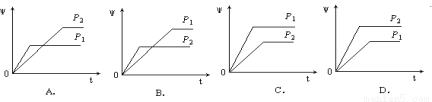
在一定温度不同压强(P1<P2)下,可逆反应2X(g)  2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O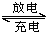 Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.充电过程中镉元素被氧化
B.充电时阳极反应:Ni(OH)2-e—+ OH—=== NiOOH + H2O
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH—向正极移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
可逆反应:2NO2 2NO+O2在恒容密闭容器中进行,达到平衡状态的是( )
2NO+O2在恒容密闭容器中进行,达到平衡状态的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑤ B.②③⑤
C.①④⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制硫酸亚铁溶液时,在配制的溶液中加入少许铁粉 | |
| B. | 发现酒精灯内酒精太少,熄火酒精灯,立即补加 | |
| C. | 用无水乙醇萃取溴水中的溴,然后通过蒸馏分离乙醇与溴 | |
| D. | 用溴的四氯化碳溶液除去甲烷中的乙烯杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | Y元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| B. | X元素最高价氧化物分子的比例模型为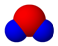 | |
| C. | Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 | |
| D. | W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在小苏打溶液中:NO3-、AlO2-、NH4+、K+ | |
| B. | 在空气中:H2S、CO2、SO2、CO | |
| C. | 在酸性高锰酸钾溶液中:C2H5OH、Na+、SO42-、CO32- | |
| D. | 在pH=8的溶液中:Na+、HCO3-、Br-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属单质在反应中只作还原剂 | |
| B. | 非金属单质在反应中只作氧化剂 | |
| C. | 金属失电子越多,其还原性越强有力 | |
| D. | Cu2+比Fe2+氧化性强,Fe比Cu还原性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com