
铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素。
(1)铁、钴、镍都是很好的配位化合物形成体。
①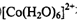 在过量氨水中易转化为
在过量氨水中易转化为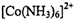 。写出
。写出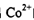 的价层电子排布图____。
的价层电子排布图____。
 中
中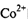 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。
H2O分子的立体构型为__________。
②铁、镍易与一氧化碳作用形成羰基配合物,如: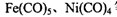 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中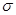 键和
键和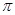 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价。NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69
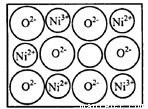
pm和78 pm,则熔点NiO____FeO(选填“<”“>”“=”); 某种天然Nio晶体存在如图所示缺陷:一个Niz+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈屯中性。某氧化镍样品组成为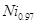 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。
(1) ①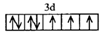 (2分)
6 (1分) sp3
(2分) V形 (2分)
(2分)
6 (1分) sp3
(2分) V形 (2分)
② 1:2 (2分) CN- (2分) (合理答案给分)
(2) > (2分) 6:91 (2分)
【解析】
试题分析:(1)①铁、钴、镍三个元素的最外层都有两个电子,仅次外层d电子分别为6、7、8;可以根据分子的空间构型或键角来判断中心原子轨道的杂化方式:sp: 直线形 180° sp2: 平面三角形 120° sp3: 正四面体 109.5°②原子的最外层达到8电子时是比较稳定的,对于CO来说,碳原子最外层是4个电子,氧原子最外层是6个电子,要形成稳定的结构,碳和氧共用两对电子,氧原子再提供一对电子作为配位键,这样双方都达到了8电子的稳定结构,即CO中有一个σ键二个π键(2)离子半径越小,熔点越高,故熔点NiO>FeO。设Ni2+:x,Ni3+:y 则x+y=0.97据化合价:2x+3y=2解之得:y=0.06 ; x=0.91
x:y=91:6.
考点:考查物质的结构与性质


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com