
| A. | W、X只能形成一种化合物 | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 离子半径:Y>Z>X | D. | X与Y不能存在于同一离子化合物中 |
分析 W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,则W是H元素,X是N元素,Y、Z处于第三周期,四元素原子的最外层电子数之和为18,Y、Z最外层电子数之和是18-1-5=12,最外层电子数只能为5、7,又Y原子序数小于Z,则Y是P元素、Z是Cl元素,据此解答.
解答 解:W、X、Y、Z均为的短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,则W是H元素,X是N元素,Y、Z处于第三周期,四元素原子的最外层电子数之和为18,Y、Z最外层电子数之和是18-1-5=12,最外层电子数只能为5、7,又Y原子序数小于Z,则Y是P元素、Z是Cl元素.
A.H、N元素可以形成NH3、N2H4等化合物,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性P<Cl,最高价氧化物的水化物酸性H3PO4<HClO4,但氧化物的水化物的酸性不一定存在此规律,如磷酸酸性大于次氯酸,故B错误;
C.电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故阴离子的半径:Y(P3-)>Z(Cl-)>X(N3-),故C正确;
D.X、Y分别是N、P元素,可以形成磷酸铵、磷酸一氢铵、磷酸二氢铵,磷酸铵、磷酸一氢铵、磷酸二氢铵都是铵盐,属于离子化合物,故D错误.
故选C.
点评 本题考查原子结构和元素性质,正确判断元素是解本题关键,易错选项是B,学生容易忽略最高价含氧酸.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1.5 mo1•L-1NaCl溶液 | B. | 75 mL 3 mol•L-1MgCl2溶液 | ||
| C. | 150 mL 2 mo1•L-1KCl溶液 | D. | 75 mL 1 mol•L-1A1C13溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)增大 | B. | H+数目增多 | C. | c(H+)增大 | D. | 导电性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
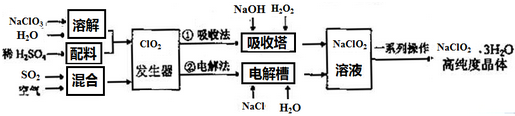
| A. | 空气的只要作用是提供氧气作氧化剂 | |
| B. | 电解法中ClO2在阴极发生的电极反应式为:ClO2+Na++e-=NaClO2 | |
| C. | 吸收法中加入H2O2主要是做还原剂 | |
| D. | 从环保的角度考虑,电解法比吸收法更环保 |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:推断题
有机化合物G常用作香料。合成G的一种路线如下:

已知以下信息:
① A的分子式为C5H8O,核磁共振氢谱显示其有两种不同化学环境的氢
② CH3CH2CH=CH2 CH3CHBrCH=CH2
CH3CHBrCH=CH2
③ CH3CHO+CH3CHO
 、
、 CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
回答下列问题:
(1)A的结构简式为______________,D中官能团的名称为____________________。
(2)B→C的反应类型为_______________。
(3)D→E反应的化学方程式为_________________________________。
(4)检验M是否已完全转化为N的实验操作是___________________________。
(5)满足下列条件的L的两种同分异构体有 种(不考虑立体异构)。① 能发生银镜反应 ② 能发生水解反应。其中核磁共振氢谱中有5组峰,且峰面积之比为1:2:2:2:3的结构简式为 。
(6)参照上述合成路线,设计一条以1-丁醇和NBS为原料制备顺丁橡胶( )的合成路线:___________________________。
)的合成路线:___________________________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(Na+)>c(B-)> c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:实验题
过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:

I、制备研究:工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(化学式为2Na2CO3·3H2O2), “醇析法”的生产工艺流程如下:

请回答问题:
(1)Na2CO3俗名:_______________;其水溶液能使酚酞变_______________;
(2)H2O2受热容易分解,写出该分解反应的方程式:_________________;
(3)生产过程中,反应及干燥均需在低温度下进行,原因是________________;
(4)生产过程中,加入较多无水乙醇后,过碳酸钠晶体大量析出,此无水乙醇的作用可能是_________________;
(5)操作A的名称是______________,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和_____________;
(6)母液可以循环使用,但须进行“一系列操作”分离,这些操作包括:加入少量___________,不再有气泡产生后,过滤,将所得滤液再进行______________(填操作名称),即可得Na2CO3溶液和95%的乙醇。为获取无水乙醇,还需进行的操作是:向95%的乙醇中加入足量CaO后,选__________(填序号)装置进行实验。

II、纯度测定:兴趣小组同学设计了如图1所示实验装置(部分仪器略去),测定过碳酸钠样品中2Na2CO3·3H2O2的质量分数。步骤如下:

① 连接仪器并检查好气密性
② 将过碳酸钠样品(2.20g)和少许MnO2均匀混合后置于装置A中,在量筒中加满水;
③ 连接仪器,打开滴液漏斗活塞,缓缓滴入水;
④ 待装置A中_____________时,停止滴加水,并关闭活塞;
⑤ 冷却至室温后,平视读数;
⑥ 根据数据进行计算。
请回答下列问题:
(7)完善实验步骤的相关内容:④ __________;
(8)第⑤中,已“冷却至室温”的判断依据是:_____________;
(9)量筒中,加装的长导管的作用是:______________;
(10)实验中,______________,则开始收集气体;
A.刚开始出现气泡时
B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(11)量筒的局部示意见图2,平视读数时应沿____________视线(选填“a”或“b”) 进行。图中________视线(选填“a”或“b”)对应的读数较大。

(12)若量筒中收集到气体的体积是224mL (己转化为标准状况下的数据),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数:_____________;[Mr(O2)=32、Mr(2Na2CO3·3H2O2)=314]
(13)经过讨论,小组同学一致认为测定结果偏大,理由是_________________(任写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com