
【题目】铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.根据所学知识回答下列问题:
(1)铁原子价电子轨道表示式为______,与铁同周期的元素的基态原子中,最外层电子数与铁相同的元素共有_____种(包含铁)。
(2)下列关于铁的说法,不正确的是_____(填选项字母)
A.基态铁原子的电子排布式1s22s22p63s23p103d24s2违反了泡利原理
B.铁属于黑色金属,在周期表中属于ds区元素
C.铁丝可用于焰色反应实验时蘸取待测物,是由于铁在光谱图中无特征的谱线
D.Fe能与CO形成配合物Fe(CO)5,配体CO中C是配原子
(3)某铁的化合物结构简式如图所示。

①组成上述化合物中5种元素原子电负性由小到大的顺序为_____。
②上述化合物中氮原子的杂化方式有_____。
③在图中用“→”标出亚铁离子的配位键_____。
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是后者,原因是_____。
【答案】3d642 9 BC O>N>C>H>Fe sp2、sp3 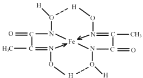 异硫氰酸中 H-N 键极性强,分子间存在氢键
异硫氰酸中 H-N 键极性强,分子间存在氢键
【解析】
(1)Fe为26号元素,所以其价电子排布式为3d642;其最外层电子排布为4s2;与铁同周期的副族元素的基态原子中,最外层电子数与铁相同的元素的3d轨道电子数可以为1、2、3、5、7、8、10,共7种,主族元素还有Ca,包括Fe共9种;
(2)A.3p能级有3个轨道,最多容纳6个电子,选项中排列违反了泡利原理,故A正确;
B.铁在元素周期表中属于d区,故B错误;
C.铁的焰色反应发出的光为无色不影响其它金属火焰颜色,所以铁丝可用于焰色反应实验,故C错误;
D.CO分子中碳氧之间有一个有氧原子问提供的配位键,使碳周围的电子云密度增加,容易给出电子,所以碳提供电子做配原子,故D正确;
综上所述答案为BC;
(3)①非金属性越强,元素的电负性越大,则电负性O>N>C>H>Fe;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4,N原子采取sp2、sp3杂化;
③C=N双键的N原子有1对孤对电子与亚铁离子之间形成配位键,另外的N原子带1个单位负电荷,与亚铁离子之间形成离子键,如图 ;
;
(4)异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸。


科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:
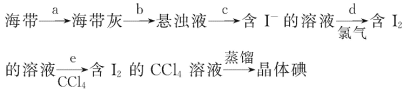
(1)步骤c的操作方法是__________;除漏斗、烧杯外,还需要使用的玻璃仪器是_________。
(2)步骤d所得溶液的颜色为_______,反应的离子方程式为_______________________________。
(3)步骤e中加入CCl4振荡、静置后,液体分为两层,上层液体呈_____色,下层液体呈______色;步骤e的操作方法是_____________,所用的主要实验仪器是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液加热反应可制取氯气,他们设计如下实验用于制取氯气并验证其性质。

试回答:
(1)该实验中A部分的装置是___________ (填写字母)。A部分的装置中发生反应的化学方程式为:___________。

(2)B中的发生反应的离子方程式为____________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因:___________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)__________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):

已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
![]()
回答下列问题:
(1)装置A中a的作用是______________;装置C中的试剂为________________;装置A中制备Cl2的化学方程为______________。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是________________。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入___________(填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为______________(填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含![]() 的质量分数表达式为_________________。
的质量分数表达式为_________________。
下列关于样品组成分析的说法,正确的是__________(填标号)。
A.![]() 时,样品中一定不含杂质
时,样品中一定不含杂质
B.![]() 越大,样品中
越大,样品中![]() 含量一定越高
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解物质的量浓度相同、体积比为2∶3的CuSO4和NaCl的混合溶液,可能发生的反应有( )
①2Cu2++2H2O![]() 2Cu+4H++O2↑
2Cu+4H++O2↑
②Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
③2Cl-+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
④2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
A.①②③B.①②④C.②③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2、NH3、O2混合气22.4L通过稀硫酸后,溶液质量增加了26.7g,气体体积缩小为4.48L。(气体体积均在标况下测定)剩余气体能使带火星的木条着火,则混合气体的平均相对分子质量为(4NO2+O2+2H2O=4HNO3)
A.28.1B.30.2C.33.1D.34.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应为HCHO+O2![]() CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A.反应物和生成物都是非极性分子
B.0.5 mol HCHO含有1 mol σ键
C.HCHO、CO2分子中中心原子杂化类型相同
D.HCHO能溶解在H2O中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示分别为氯化钠、氯化铯、氟化钙的晶胞模型,请认真观察后完成表格。___________

离子晶体 | 晶体结构粒子 | 晶胞所含粒子数 | 配位数 | 阴阳离子个数之比 | ||
阴离子 | 阳离子 | 阴离子 | 阳离子 | |||
氯化钠 | ||||||
氯化铯 | ||||||
氟化钙 | ||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
编号 | ① | ② | ③ | ④ |
A中气体 | H2S | H2 | NH3 | NO |
B中气体 | SO2 | Cl2 | HCl | O2 |
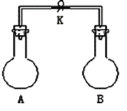
A.②③④①B.③①④②
C.③②①④D.④③②①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com