
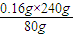 =0.48g
=0.48g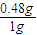 ×100%=48%.
×100%=48%.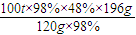 =78.4t,
=78.4t,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业生产应考虑综合经济效益问题。
⑴若1g含SiO2和FeS2的某硫铁矿样品,在氧气中充分燃烧,残余固体质量为0.84g。某硫酸厂每天用这种矿石500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%,则每天可以制得98%的H2SO4质量为 t。
⑵某硫酸厂以硫为原料每天生产98%的H2SO4 a t。若送风(鼓入空气)后使硫充分燃烧,并在下一步催化氧化时不再补充空气,设送风机每天输送空气的体积为b m3/台(标准状况)。求理论上至少应安装 台送风机(空气中氧气的体积分数为21%)。
⑶硫酸工业的尾气通常是转化为硫酸铵的。若尾气中SO2、O2的体积分数分别为0.4%和0.5%。向尾气中通入空气(设空气中O2的体积分数为20.5%,且不含SO2),在400℃、催化剂作用下反应,再与NH3混合,同时喷水降温至200℃,在热的结晶装置中得到(NH4)2SO4晶体。若某硫酸厂每天排放出的尾气为5×105m3(标准状况),按上述方法该厂每月(以30天计)最多能获得 吨硫酸铵?
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修2 2.3硫酸工业练习卷(解析版) 题型:计算题
取1g含SiO2和FeS2的矿石样品,在氧气中充分燃烧,残余固体质量为0.84g,用这种矿石100吨,可以制得98%的H2SO4多少吨?(设生产过程中硫损失2%)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com