
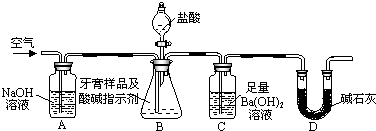
分析 (1)实验通过C装置生成的碳酸钡的质量测定二氧化碳的质量,进而计算牙膏中碳酸钙的质量分数.装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小;
(2)二氧化碳与氢氧化钡反应生成碳酸钡与水;
(3)A、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定;
B、滴加盐酸过快CO2,CO2不能完全被吸收,排出装置C;
C、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2;
D、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2;
(4)BaCO3质量为3.94g n(BaCO3)=0.0200mol,则n(CaCO3)=0.0200mol,质量为2.00g;
(5)B中的水蒸气、氯化氢气体等进入装置C中;
解答 解:(1)装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小,持续缓缓通入空气的作用为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收;
故答案为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收;
(2)二氧化碳与氢氧化钡反应生成碳酸钡与水,反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O,
故答案为:Ba2++2OH-+CO2=BaCO3↓+H2O;
(3)A、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度,故A不符合;
B、滴加盐酸过快CO2,CO2来不及被吸收,就排出装置C,滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度,故B不符合;
C、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度,故C符合;
D、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,影响CO2,不能提高测定准确度,故D符合;
故选:CD;
(4)BaCO3质量为3.94g,则n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2g,所以样品中碳酸钙的质量分数为$\frac{2g}{8g}$×100%=25%,
故答案为:25%;
(5)B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高,
故答案为:B中的水蒸气、氯化氢气体等进入装置C中.
点评 本题考查较为综合,以物质的制备实验为载体,综合考查实验的设计、物质的分离、提纯等知识,对实验原理与操作步骤的理解及评价、常用化学用语、化学计算、物质组成的测定等,注意根据物质的性质设计实验方案,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子学说 | B. | 分子学说 | C. | 等电子体学说 | D. | 元素周期律 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点:H2T<H2R | B. | M与T形成的化合物具有两性 | ||
| C. | 单质与稀盐酸反应的速率:L<Q | D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是甲烷燃料电池原理示意图,回答下列问题:
如图是甲烷燃料电池原理示意图,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com