
分析 (1)碳酸根和盐酸反应产生二氧化碳气体,钡离子、铝离子、三价铁离子和碳酸根不共存,碳酸氢铵溶液和盐酸反应产生二氧化碳气体,HCO3-和AlO2-反应产生氢氧化铝沉淀,Ba(OH)2溶液和碳酸氢铵溶液反应产生氨气和碳酸钡白色沉淀;
(2)实验①中偏铝酸根离子和酸反应生成铝离子,碳酸根离子和氢离子反应生成二氧化碳和水;
(3)过量盐酸中加入过量碳酸氢铵溶液,碳酸氢铵溶液和盐酸反应产生二氧化碳气体;碳酸氢铵溶液中的HCO3-和AlO2-之间能反应产生氢氧化铝沉淀;
(4)②所得溶液中有剩余的碳酸氢铵,Ba(OH)2溶液能和碳酸氢铵溶液反应产生氨气和碳酸钡白色沉淀,硫酸根是否存在不确定,可能有BaSO4.
解答 解:(1)所有离子中只有碳酸根和盐酸反应产生气体二氧化碳,所以一定含有碳酸根离子,而钡离子、铝离子、三价铁离子和碳酸根不共存,所以一定没有钡离子、铝离子、三价铁离子,溶液中必须有阳离子,所以一定含有钠离子,过量盐酸中加入过量碳酸氢铵溶液,碳酸氢铵溶液和盐酸反应产生二氧化碳气体,碳酸氢铵溶液中的HCO3-和AlO2-之间能反应产生氢氧化铝沉淀,所以一定含有AlO2-,②所得溶液中有剩余的碳酸氢铵,Ba(OH)2溶液能和碳酸氢铵溶液反应产生氨气和碳酸钡白色沉淀,所以硫酸根是否存在不确定,
故答案为:Ba2+、Al3+、Fe3+;SO42-;
(2)①加入过量盐酸,有气体生成,只有碳酸根和盐酸反应产生气体二氧化碳,CO32-+2H+=H2O+CO2↑,根据以上分析还有H+和AlO2-之间反应,AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+4H+=Al3++2H2O;CO32-+2H+=H2O+CO2↑;
(3)②在上面所得的溶液中再加入过量碳酸氢铵溶液,过量盐酸中加入过量碳酸氢铵溶液,碳酸氢铵溶液和盐酸反应产生二氧化碳气体,碳酸氢铵溶液中的HCO3-和AlO2-之间反应产生氢氧化铝沉淀,
故答案为:CO2;Al(OH)3;
(4)铵根离子和氢氧根离子反应生成氨气,碱性溶液中碳酸氢根离子和碱反应生成碳酸根离子,碳酸根离子和钡离子反应生成碳酸钡沉淀,硫酸根是否存在不确定,可能有BaSO4,
故答案为:NH3;BaCO3或BaCO3与BaSO4的混合物.
点评 本题考查了常见离子的检验方法,题目难度中等,注意根据溶液呈电中性判断溶液中存在的离子方法,本题充分考查了学生的分析、理解能力,要求熟练掌握常见离子的检验方法.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | |
| B. | NH4Cl的电子式: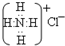 | |
| C. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| D. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
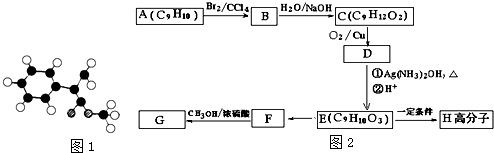
 ;
;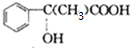 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$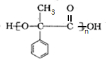 +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
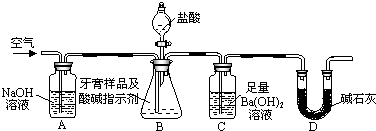
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
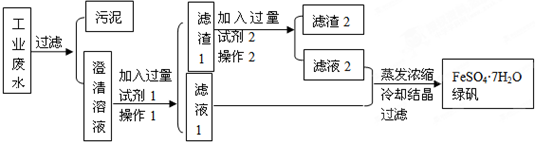
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:8:12 | B. | 15:14:21 | C. | 10:14:21 | D. | 30:28:23 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com