
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
【答案】增大晶体的表面积,加快反应的速度 NH4Cl溶于水电离出的NH4+,增大溶液中c(NH4+),使NH3·H2ONH4++OH-电离平衡逆移降低c(OH-),防止加氨水时溶液中c(OH-)过大使钴(II)离子沉淀 温度过高会导致 H2O2 大量分解,降低产率 2Co(NH3)62+ + H2O2= 2Co(NH3)63+ + 2OH- 22.125%
【解析】
由于Co2+在 pH=9.4 时完全沉淀为 Co(OH)2,将CoCl2·6H2O晶体研细先加入氯化铵溶液,再加入浓氨水反应生成[Co(NH3)6]Cl2,[Co(NH3)6]Cl2和H2O2发生氧化反应生成[Co(NH3)6]Cl3。
(1)实验中需要将CoCl2·6H2O晶体研细,其目的是增大晶体的表面积,加快反应的速度;故答案为:增大晶体的表面积,加快反应的速度。
(2)根据题中信息Co2+在pH=9.4时完全沉淀为Co(OH)2,因此在加入浓氨水前先加入大量NH4Cl溶液,主要是NH3·H2O NH4++OH-,能电离出OH-,易和Co2+反应生成Co(OH)2,NH4Cl溶于水电离出的NH4+,增大溶液中c(NH4+),使电离平衡逆向移动,降低c(OH-)浓度,防止加氨水时溶液中c(OH-)过大使钴(II)离子沉淀;故答案为:NH4Cl溶于水电离出的NH4+,增大溶液中c(NH4+),使NH3·H2ONH4++OH-电离平衡逆移降低c(OH-),防止加氨水时溶液中c(OH-)过大使钴(II)离子沉淀。
(3)H2O2 在较高温度下会导致大量分解,氧化效果降低,从而降低产率,因此在“氧化”过程中需水浴控温在50~60℃,温度不能过高;故答案为:温度过高会导致 H2O2 大量分解,降低产率。
(4)“氧化”过程中Co(NH3)62+ 与H2O2反应生成Co(NH3)63+ 和OH-,其离子方程式2Co(NH3)62+ + H2O2= 2Co(NH3)63+ + 2OH-;故答案为:2Co(NH3)62+ + H2O2= 2Co(NH3)63+ + 2OH-。
(5)根据方程式可得关系式Co3+ ~ S2O32,n(Co3+)= n(S2O32)= 0.100 0 molL1×0.015 mL×10 =0.015mol,![]() ;故答案为:22.125%。
;故答案为:22.125%。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一种碳纳米管新型二次电池的装置如图所示。下列说法中正确的是

A. 离子交换膜选用阳离子交换膜(只允许阳离子通过) B. 正极的电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
C. 导线中通过1mol电子时,理论上负极区溶液质量增加1g D. 充电时,碳电极与电源的正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为,苯分子的结构中碳碳间以单、双键交替排列结合成环状。为了验证凯库勒的观点,某同学设计了以下实验方案:

①按如图所示的装置连接好仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量FeBr3,塞上橡皮塞,打开止水夹K1、K2、K3;
④待烧瓶a中收集满气体后,将导管b的下端插入烧杯D里的水中,挤压预先盛有水的胶头滴管,观察实验现象。
(1)A中所发生反应的反应类型为________,能证明凯库勒观点错误的实验现象是________________________________________________________________。
(2)装置B的作用是___________________________________。
(3)装置A中发生反应的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于![]() 的说法错误的是
的说法错误的是
A.属于金属元素B.![]() 和
和![]() 是钇元素的两种同位素
是钇元素的两种同位素
C.原子的核外电子数为39D.质子数与中子数之差为50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( )
A. 接近称量质量时,轻振手腕,加够药品
B. 溶解时,用量筒控制所加蒸馏水的量
C. 移液时,玻璃棒插在刻度线上,防止液体洒出![]()
D. 接近刻度线1~2cm时,用胶头滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的矿产、能源和水产资源,如图所示利用海水的部分流程。
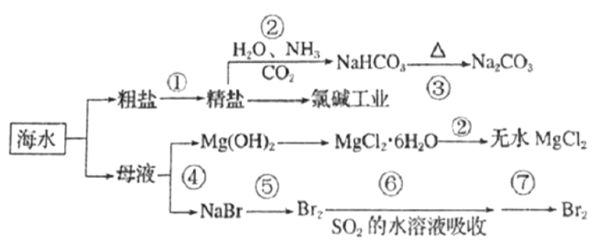
下列有关说法正确的是( )
A. 步骤②制取NaHCO3的原理是利用其溶解度比较小
B. 步骤②属于化合反应,步骤③属于分解反应
C. 在⑤⑥⑦步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度时:2SO2(g)+O2(g)![]() 2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
2SO3(g),当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密闭容器中通入2mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
A.Q=197 kJ B.Q<197×2 kJ C.Q<197 kJ D.Q>197 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是一种常用的消毒剂,易溶于水、易挥发、见光或受热易分解。其制备原理为:![]() △H<0,同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图。
△H<0,同时利用乙酸丁酯与水形成共沸物(沸点90.7℃)及时分离出水,以提高产率。实验装置如图。

(1)过氧乙酸保存时应注意______________(填标号)。
A.避光B.低温C.密闭D.隔绝空气
(2)仪器a的名称为______________,其中盛放的试剂为______________(填“乙酸”或“双氧水”)。
(3)为减少反应瓶中乙酸丁酯的损耗,反应开始前,在油水分离器中应进行的操作是______________。
(4)反应体系采用减压的目的是____。
(5)过氧乙酸(含有少量H2O2杂质)的含量测定流程如图。
![]()
①判断H2O2恰好除尽的实验现象是______________。
②过氧乙酸被Fe2+还原,还原产物之一为乙酸,其离子方程式为______________
③若样品体积为VomL,加入c1mol·L-1FeSO4溶液V1mL,消耗c2mol·L-1K2Cr2O7溶液V2mL。则过氧乙酸含量为______________g.L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的共有几个( )
①NH3和H2O ②BF3和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥![]() 和
和![]() ⑦NF3和Al2Cl6
⑦NF3和Al2Cl6
A.6B.5C.4D.3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com