
【题目】下列各组微粒的空间构型相同的共有几个( )
①NH3和H2O ②BF3和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和BeCl2 ⑥![]() 和
和![]() ⑦NF3和Al2Cl6
⑦NF3和Al2Cl6
A.6B.5C.4D.3
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的溶液中:Cu2+、Mg2+、![]() 、
、![]()
B.弱碱性溶液中:K+、Na+、I-、ClO-
C.中性溶液中:Fe3+、K+、Cl-、![]()
D.能使甲基橙变红的溶液中:Al3+、Na+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
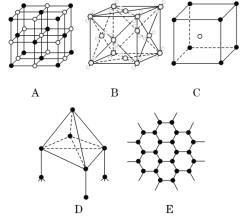
(1)代表金刚石的是(填编号字母,下同)____,其中每个碳原子与____个碳原子最接近且距离相等;
(2)代表石墨的是______,每个正六边形占有的碳原子数平均为____个;
(3)代表NaCl的是_______ ,代表CsCl的是_____,每个Cs+与____个Cl-紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素A、B、C、D,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为__________(写出元素符号),电子排布式是_____________;
(2)C为________(写出元素符号),价电子排布式是________________;
(3)D的电子排布图是__________;
(4)E的原子结构示意图是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是( )

A.简单离子半径:Z<Y
B.第一电离能:Y<X
C.m中存在离子键和极性键
D.W2Y2中含有非极性键,为极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取未知浓度的AOH和BOH两种碱的稀溶液,加水稀释至原体积的n倍。两溶液稀释倍数的对数值(lgn)与溶液的pH变化关系如图所示。下列叙述正确的是

A.水的电离程度:Z>X=Y
B.常温下,Kb(BOH)<Kb(AOH)
C.中和等体积X、Y两点溶液,后者消耗HC1的物质的量多
D.物质的量浓度相同的AC1溶液和BC1溶液,前者阳离子浓度之和小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A. CH4 C3H6 B. CH4 C2H4 C. C2H4 C3H4 D. C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列仪器的名称

② _____________③____________④________________
(2)分离出碘水中的碘应先选择装置____________(填I、II、III) 进行操作;
该分离提纯的方法叫_____________ ;
进行该操作,需加一试剂,在选择试剂时,下列性质你认为哪些性质是必需的:____________(填序号)
①与碘水不反应 ②I2在其中溶解程度大于在水中的溶解度 ③与水不相容 ④密度要比水小
如果选择苯C6H6(是一种密度比水小的有机溶剂)作这种试剂,现象是________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com