
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3,还含有硅、铝等杂质。制备流程如图所示:
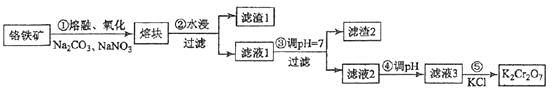
回答下列问题:
⑴步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4 + Fe2O3 + CO2+ NaNO2
Na2CrO4 + Fe2O3 + CO2+ NaNO2
上述反应配平后FeOCr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________(可用化学方程式表示)。
⑵步骤④调滤液2的pH使之变_________(填“大”或“小”),原因是_________(用离子方程式表示)。
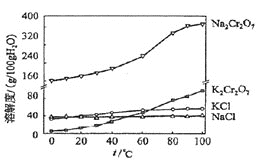
⑶有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到10℃得到的K2Cr2O7固体产品最多,步骤⑤的反应类型是___________________。
【答案】2:7 Na2CO3+SiO2 ![]() Na2SiO3 + CO2↑ 小 增大溶液中
Na2SiO3 + CO2↑ 小 增大溶液中![]() ,促进平衡CrO42- + 2H+
,促进平衡CrO42- + 2H+ ![]() Cr2O72-+ H2O正向移动 复分解反应
Cr2O72-+ H2O正向移动 复分解反应
【解析】
⑴先根据氧化还原反应配平方程式,得出FeOCr2O3与NaNO3的系数比;不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应;
⑵步骤④中调节pH发生CrO42-转化为Cr2O72-;则步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72-;
⑶步骤⑤发生Na2Cr2O7与KCl反应。
⑴由上述分析可知步骤①的主要反应为:2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4 + Fe2O3 + 4CO2↑+ 7NaNO2,则FeOCr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,方程式为Na2CO3+SiO2
4Na2CrO4 + Fe2O3 + 4CO2↑+ 7NaNO2,则FeOCr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,方程式为Na2CO3+SiO2 ![]() Na2SiO3 + CO2↑;故答案为:2:7;Na2CO3+SiO2
Na2SiO3 + CO2↑;故答案为:2:7;Na2CO3+SiO2 ![]() Na2SiO3 + CO2↑;
Na2SiO3 + CO2↑;
⑵步骤④中调节pH发生CrO42-+ 2H+ ![]() Cr2O72-+ H2O,则步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72-;故答案为:小;增大溶液中
Cr2O72-+ H2O,则步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72-;故答案为:小;增大溶液中![]() ,促进平衡CrO42-+ 2H+
,促进平衡CrO42-+ 2H+ ![]() Cr2O72-+ H2O正向移动;
Cr2O72-+ H2O正向移动;
⑶步骤⑤发生Na2Cr2O7 + KCl = K2Cr2O7↓+ NaCl,反应类型是复分解反应;故答案为:复分解反应。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】利用生活中或实验室中的常用物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池.请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)实验用品:电极(__、__)、稀硫酸、__、__耳机(或电流计).
(3)①按如图所示装置连接好实验仪器,这时可以听见耳机发出“嚓嚓……”的声音。其原因是在原电池中化学能转化为__,在耳机中__又转化为声波这种能量。
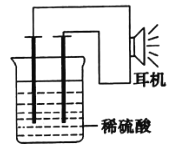
②在该原电池内中,Fe在___极发生了___反应,H+在___极发生了___反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:

下列说法正确的是
A.m>nB.Q<0
C.温度不变,压强增大,Y的质量分数减少D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g) + 2B2(g)![]() 2AB2(g) ΔH < 0,列说法正确的是 ( )
2AB2(g) ΔH < 0,列说法正确的是 ( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度有利于反应速率增加,从而缩短达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 1 mol B和3 mol C
B. 2 mol A、1mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C
D. 2 mol A、3mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeO·Cr2O3、SiO2等)制备,制备流程如图所示:
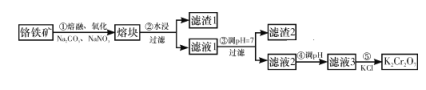
已知:
Ⅰ.步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
Ⅱ.2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
下列说法正确的是( )
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8 L CO2共转移7 mol电子
C. 步骤④若调节滤液2的pH,使之变小,则有利于生成Cr2O72-
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7的溶解度大于Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
(1)写出下列有机物的结构简式:
①2,2,3,3-四甲基戊烷_________;
②2,5-二甲基庚烷____________;
③2,3-二甲基-6-乙基辛烷__________。
(2)写出下列物质的分子式:
①![]() ___________;
___________;
②![]() ___________;
___________;
(3)写出下列物质的键线式:
①![]() ___________;
___________;
②CH3CH=CHCH3___________;
(4)按系统命名法命名有机物CH3CH(C2H5)CH(CH3)2的名称是___________;
(5)![]() 所含官能团的名称是___________;该有机物发生加聚反应后,所得产物的结构简式为__________________。
所含官能团的名称是___________;该有机物发生加聚反应后,所得产物的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
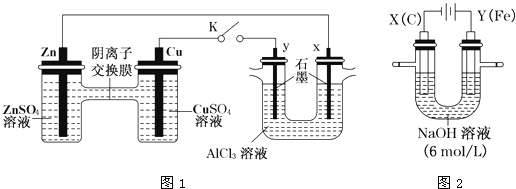
请回答:
Ⅰ.用图1所示装置进行第一组实验(K闭合)。
(1)Zn极为________极;实验过程中,SO42-____________(填“从左向右”、“从右向左”或“不”)移动。
(2)反应初期,y极的电极反应现象为________________;检验y极反应产物的方法是________________。
(3)Cu极的电极反应式为____________。
(4)Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。电解过程中,X极的电极反应式为__________。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和4OH--4e-=2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g)△H1,平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)△H1,平衡常数为K1;反应②Fe(s)+H2O(g) ![]() FeO(s)+H2(g)△H2,平衡常数为K2。在不同温度时K1、K2的值如下表:
FeO(s)+H2(g)△H2,平衡常数为K2。在不同温度时K1、K2的值如下表:

反应 CO2(g) + H2(g) ![]() CO(g) + H2O(g) △H,平衡常数K,则△H=_____________________(用△H1和△H2表示),K=____________________________________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常数K,则△H=_____________________(用△H1和△H2表示),K=____________________________________(用K1和K2表示),且由上述计算可知,反应CO2(g) + H2(g) ![]() CO(g) + H2O(g)是___________________反应(填“吸热”或“放热”)。
CO(g) + H2O(g)是___________________反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H >0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) △H >0,CO2的浓度与时间的关系如图所示:
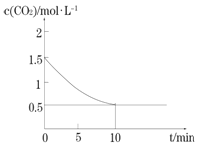
①该条件下反应的平衡常数为________________________________________;
②下列措施中能使平衡时c(CO)/c(CO2)增大的是______________________________________(填序号)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
③一定温度下,在一个固定容积的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是________________________________(填字母)。
a.容器中压强不变 b.气体的密度不再改变 c.υ正(CO2)= υ逆(CO)
d.c(CO2)= c(CO) e.容器内气体总物质的量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com