
【题目】700℃时,向容积为2 L的恒容密闭容器中充入一定量的CO和H2,发生如下反应:
CO(g)+2H2(g)![]() CH3OH(g),反应过程中测定的部分数据见下表:
CH3OH(g),反应过程中测定的部分数据见下表:
反应时间/min | n(CO)/mol | n(H2)/ mol |
0 | 0.60 | 1.20 |
20 | 0.20 | |
30 | 0.40 |
下列说法正确的是
A. 反应在20 min内的平均速率为v(H2)=0.04 mol·L-1·min-1
B. 保持其他条件不变,升高温度,平衡时c(CH3OH)= 0.15 mol·L-1,则反应的ΔH<0
C. 保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,达到新平衡前v(正)> v(逆)
D. 相同温度下,若起始时向容器中充入1.0 mol CH3OH,达到平衡时CH3OH转化率大于1/3
【答案】BC
【解析】
由反应可知,30min时转化的氢气为0.8mol,则转化的CO为0.4mol,则剩余的CO为0.6mol-0.4mol=0.2mol,可知20min时达到平衡,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 0.6 1.2 0
转化 0.4 0.8 0.4
平衡 0.2 0.4 0.4
A.结合v=![]() 计算;
计算;
B.平衡时c(CH3OH)=0.2mol/L,升高温度,平衡时c(CH3OH)=0.15 molL-1,可知升高温度平衡逆向移动;
C.K=![]() =50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=
=50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=![]() =16.67<K,平衡正向移动;
=16.67<K,平衡正向移动;
D.若起始时向容器中充入1.0 mol CH3OH,设转化的甲醇为x,K=![]() =0.02,
=0.02,
CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
开始 1.0 0 0
转化 x x 2x
平衡 1-x x 2x
![]() =0.02,如x=
=0.02,如x=![]() 时,
时,![]() >0.02,则x<
>0.02,则x<![]() 时满足题意。
时满足题意。
由反应可知,30min时转化的氢气为0.8mol,则转化的CO为0.4mol,则剩余的CO为0.6mol-0.4mol=0.2mol,可知20min时达到平衡,则
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
开始 0.6 1.2 0
转化 0.4 0.8 0.4
平衡 0.2 0.4 0.4
A.反应在20 min内的平均速率为v(H2)=![]() =0.02molL-1min-1,选项A错误;B.平衡时c(CH3OH)=0.2mol/L,升高温度,平衡时c(CH3OH)=0.15 molL-1,可知升高温度平衡逆向移动,则反应的△H<0,选项B正确;C.K=
=0.02molL-1min-1,选项A错误;B.平衡时c(CH3OH)=0.2mol/L,升高温度,平衡时c(CH3OH)=0.15 molL-1,可知升高温度平衡逆向移动,则反应的△H<0,选项B正确;C.K=![]() =50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=
=50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=![]() =16.67<K,平衡正向移动,则达到新平衡前v(正)>v(逆),选项C正确;D.若起始时向容器中充入1.0 mol CH3OH,设转化的甲醇为x,K=
=16.67<K,平衡正向移动,则达到新平衡前v(正)>v(逆),选项C正确;D.若起始时向容器中充入1.0 mol CH3OH,设转化的甲醇为x,K=![]() =0.02,
=0.02,
CH3OH(g)![]() CO(g)+2H2(g)
CO(g)+2H2(g)
开始 1.0 0 0
转化 x x 2x
平衡 1-x x 2x
![]() =0.02,如x=
=0.02,如x=![]() 时,
时,![]() >0.02,则x<
>0.02,则x<![]() 时满足题意,则达到平衡时CH3OH转化率小于
时满足题意,则达到平衡时CH3OH转化率小于![]() ,选项D错误;答案选BC。
,选项D错误;答案选BC。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线拧在一起
②汽车尾气中含有能污染空气的氮氧化物,主要是汽油燃烧不充分造成的
③从海水中提取物质都必须通过化学反应才能实现
④“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料
⑤明矾可以用于净水,主要是由于Al3+水解生成的少量氢氧化铝胶体有净水作用
A.②③⑤ B.①②④ C.①③④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含氧有机化合物可以作为无铅汽油的抗爆震剂,其相对分子质量为88.0,含C的质量分数为0.682,含H的质量分数为0.136,其余为O。
(1)试确定该化合物的分子式______。(写出计算过程)
(2)经红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通电条件下,用如图所示装置由乙二醛(OHC-CHO)制备乙二酸(H00C-COOH)。其制备反应为:OHC-CHO+2Cl2+2H2O→HOOC-COOH+4HCl。下列说法正确的是
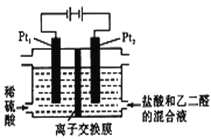
A. 每消耗0.1mol乙二醛在Pt1极放出2.24L气体(标准状况)
B. Pt1的电极反应为:4OH--4e-=2H2O+O2↑
C. 盐酸是起提供Cl-和增强导电性的作用
D. 每得到lmol乙二酸将有2molH+从右室迁移到左室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(ClO3-在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(Cr2O72-被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________。
②实验中加热煮沸的目的是___________。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
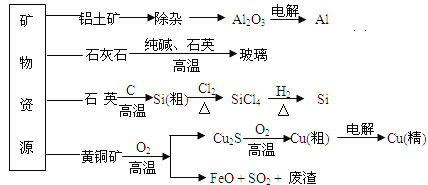
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是______________。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:_________
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是________________________________。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是______________________。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在当下热播的电视剧《人民的名义》中,达康书记正在参加省委召开的“开展垃圾分类,建设美丽厦门”扩大会议。达康书记问环保局长: 下列哪一组垃圾都是可回收垃圾
A. 果皮、旧报纸、废电池 B. 剩饭、鱼骨头、玻璃瓶
C. 饮料瓶、玻璃酒瓶、废作业本 D. 易拉罐、旧衣物、手机电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com