
【题目】(1)下列物质:①氯气,②澄清石灰水,③水银,④稀盐酸,⑤氯化铜固体,⑥熔融氢氧化钠,⑦蔗糖,⑧酒精,⑨二氧化碳,⑩硫酸钡。其中属于电解质的是______(填序号,下面相同),属于非电解质的是_________,能导电的是_________。
(2)写出高锰酸钾受热分解制氧气的化学反应方程式____________________,反应中的氧化剂是________,还原产物是____________,当有2mol电子转移时,生成的氧气在标准状况下的体积是________L。
【答案】⑤⑥⑩ ⑦⑧⑨ ②③④⑥ 2KMnO4![]() K2MnO4+O2↑+MnO2 KMnO4 K2MnO4、MnO2 11.2
K2MnO4+O2↑+MnO2 KMnO4 K2MnO4、MnO2 11.2
【解析】
(1) ①氯气是由分子构成的单质,不能导电,不是电解质,也不是非电解质;
②澄清石灰水中含有自由移动的离子,能够导电,它是混合物,不是电解质,也不是非电解质;
③水银是液态金属单质,能够导电,不是电解质,也不是非电解质;
④稀盐酸是混合物,含有自由移动的离子,能够导电,不是电解质,也不是非电解质;
⑤氯化铜固体是离子化合物,有离子,但离子不能自由移动,所以不能导电,是电解质,;
⑥熔融氢氧化钠是离子化合物,含有自由移动的离子,能够导电,属于电解质;
⑦蔗糖是共价化合物,由分子构成,无离子,不能导电,属于非电解质;
⑧酒精是共价化合物,由分子构成,无离子,不能导电,属于非电解质;
⑨二氧化碳是共价化合物,由分子构成,无离子,不能导电,属于非电解质;
⑩硫酸钡是难溶性的离子化合物,无自由移动的离子,不能导电,属于电解质。综上所述可知其中属于电解质的是⑤⑥⑩,属于非电解质的是⑦⑧⑨,能导电的是②③④⑥。
(2)高锰酸钾不稳定,受热分解产生氧气,反应的化学反应方程式是2KMnO4![]() K2MnO4+MnO2+O2↑;在该反应中,Mn元素的化合价由反应前KMnO4中的+7价变为反应后K2MnO4中的+6价和MnO2中的+4价,化合价降低,获得电子,被还原,所以KMnO4是氧化剂,K2MnO4和MnO2是还原产物。每有1molO2产生,转移4mol电子,则有2mol电子转移时,反应产生0.5molO2产生,其体积在标准状况下是V(O2)= 0.5mol×22.4L/mol=11.2L。
K2MnO4+MnO2+O2↑;在该反应中,Mn元素的化合价由反应前KMnO4中的+7价变为反应后K2MnO4中的+6价和MnO2中的+4价,化合价降低,获得电子,被还原,所以KMnO4是氧化剂,K2MnO4和MnO2是还原产物。每有1molO2产生,转移4mol电子,则有2mol电子转移时,反应产生0.5molO2产生,其体积在标准状况下是V(O2)= 0.5mol×22.4L/mol=11.2L。


科目:高中化学 来源: 题型:
【题目】某些烃的分子结构模型如图所示。

回答下列问题:
(1) 属于比例模型的是_______(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是_______;
(3)存在同分异构体的是_______;写出其同分异构体的结构简式___________;
(4) C10H14属于苯的同系物的所有同分异构体共有_______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是____________。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
(3)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 1L水中溶解了40.0 g NaOH,该溶液的物质的量浓度为1 mol/L
B. 从1L2mol/L的NaCl液中取出0.5L,取出的该溶液的浓度为1mol/L
C. 中和100 mL 1mol/L的H2SO4溶液,需NaOH8.0g
D. 配制500mL0.5mol/L的CuSO4溶液,需40.0g胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为阳离子交换膜法电解精制的饱和食盐水原理示意图。其中阳离子交换膜仅允许Na+通过。下列说法错误的是
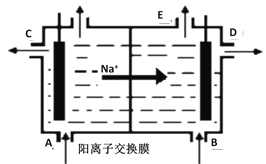
A. 从A口加入精制的浓食盐水
B. 从E口放出的气体是H2
C. D口导出的是含少量氯化钠的NaOH溶液
D. B口NaOH的浓度小于D口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有关知识回答下列问题。
(Ⅰ)研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
(1)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH 1 =+489 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH 2 = +172 kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式___________________________。
(2)利用CO燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式_____________________________________。
(Ⅱ)初中我们学过铜不能与稀硫酸反应。某学生利用上述CO/O2燃料电池设计了如图所示装置(框内部分未画出),实现了铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4(未注明反应条件)。回答下列问题。
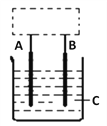
(3)A是石墨棒,B是一种金属,该金属是________(填名称)。
(4)B应接电源的________极(填“通入CO”或“通入O2”)。
(5)写出该装置中发生还原反应的电极反应式___________________________________。
(6)若C溶液为100mL饱和食盐水,A和B电极均为石墨棒,该学生连通电路,写出烧杯中反应的离子方程式_________________,当放出标况下112mL氢气时,该溶液的pH=_____________(室温下)。
(Ⅲ)将(Ⅱ)中装置改造成下图装置,可以模拟铁的电化学防护。

(7)若X为铜,为减缓铁的腐蚀,开关K应置于______处。
(8)若X为锌棒,开关K置于M处,该电化学防护法称为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是 ( )
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3。下列对这四种气体的关系从小到大表示不正确的是
A. 密度;①<④<③<②
B. 体积 ④<①<②<③
C. 质量 ④<①<③<②
D. 氢原子数 ②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆(40Zr)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是ZrSiO4,还含有少量A12O3、SiO2、Fe2O3等杂质)为原料生产锆及其化合物的流程如图所示:
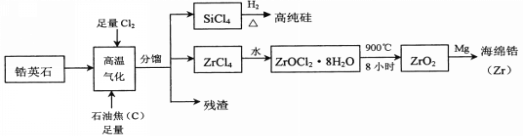
(1)SiCl4的电子式为__________。上述流程中,高温气化存在多个反应,若不考虑反应中的损失,则分馏后得到的SiCl4质量通常比由纯ZrSiO4发生的反应得到的SiCl4质量大,原因是___________________________________________________。
(2)高温气化后的固体残渣除C外,还含有的金属元素有________
(3)写出上述流程中ZrCl4与水反应的化学方程式:_____________________。
(4)锆还是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷。下列关于锆、二氧化锆的叙述中,正确的是_____(填序号)。
a.锆合金比纯锆的熔点高,硬度小
b.二氧化锆陶瓷属于新型无机非金属材料
c.将一束光线通过纳米级二氧化锆会产生一条光亮的通路
d.可采用氦作反应堆包裹核燃料的锆合金的冷却剂
(5)工业上电解K2ZrF6与KCl等组成的熔体也可制取金属锆。写出电解的总反应方程式并标明
电子转移的方向和数目 _________________________________________________。
(6)某燃料电池是以C2H4作为燃料气,另一极通入氧气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-,则负极上发生的反应式为_____________________。
(7)极稀溶液中溶质的物质的量浓度很小,常用其负对数pc表示(pcB=-lgcB)。如某溶液中溶质的物质的量浓度为1×10﹣5mol·L﹣1,则该溶液中溶质的pc=5。下列说法正确的是_____
A.电解质溶液的pc(H+)与pc(OH﹣)之和均为14
B.用盐酸滴定某浓度的KOH溶液,滴定过程中pc(H+)逐渐增大
C.BaCl2溶液中逐滴加入硫酸溶液,滴加过程中pc(Ba2+)逐渐减小
D.某温度下Ksp(Zr(CO3)2)=4.0×10﹣12,则其饱和溶液中pc(Zr4+)+ pc(CO32﹣)=7.7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com