
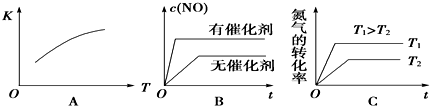
分析 (1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,带入v=$\frac{△n}{V•△t}$计算;
(2)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)根据温度、催化剂对反应速率和平衡移动的影响判断;
(4)根据化学方程式的特点结合压强对平衡的影响分析;
(5)计算某时刻生成物的浓度幂之积与反应物浓度幂之积的比值,与该温度下的平衡常数相比较,可得出结论.
解答 解:(1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,v(N2)=$\frac{△n}{V•△t}$=$\frac{0.5mol}{2L×5min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(2)A.消耗1mol N2等效于消耗1mol O2,同时生成1mol O2,故选;
B.混合气体密度一直不变,故不选;
C.混合气体平均相对分子质量不变,总质量是个定值,总物质的量是个定值,混合气体的平均相对分子质量一直不变,故不选;
D.2v(N2)正=v(NO)正=v(NO)逆,故选;
故选:AD;
(3)(3)A、该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;
B、加入催化剂,反应速率增大,但平衡不发生移动,故B错误;
C、升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确;
故答案为:AC;
(4)该反应中,气体的化学计量数之和前后相等,压强对平衡移动没有影响,只要是在相同温度下,则平衡状态相同,与原平衡状态相比,此时平衡混合气中NO的体积分数,故答案为:不变;
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则有该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为:$\frac{(3×1{0}^{-3})2}{(2.5×1{0}^{-1})×(4.0×1{0}^{-2})}$=9×10-4<K,则反应应向正反应方向进行,
故答案为:向正反应方向进行;因为浓度商Qc<K.
点评 本题考查化学平衡的有关计算,题目难度中等,注意平衡常数的计算和应用.


科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉有大量氢气产生的溶液中:Mg2+、K+、NO3-、SiO32- | |
| B. | 在0.1mol/L氢氧化钠的溶液中:Na+、K+、Cr2O72-、S2- | |
| C. | 在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在0.1mol/L的硝酸溶液中:NH4+、Ca2+、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
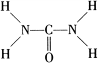 .另外尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.请回答下列问题:
.另外尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力建设火力发电站,充分利用我国煤资源丰富的国情特点 | |
| B. | 发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖 | |
| C. | 推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料 | |
| D. | 推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
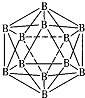 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: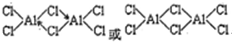 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s);△H=-26.5kJ/mol,由此可知I2(s)+H2(g)?2 HI(g);△H=+26.5kJ/mol | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 | |
| D. | 放热反应在常温下一定很容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | Sr(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | |||
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 比值$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com