

分析 根据质谱图可知,此有机物的相对分子质量为62.故6.2gA的物质的量为0.1mol,设其分子式为CxHyOz.
取6.2g A即0.1molA完全燃烧,将生成的产物经浓硫酸吸收后通过碱石灰.经称量得知,浓硫酸增重5.4g为的水的质量,求出水的物质的量;碱石灰增重8.8g为二氧化碳的质量,求出二氧化碳的物质的量.
根据C、H原子守恒可解得xy值,然后根据由于此有机物的相对分子质量为62,解得z值,从而确定有机物的分子式.
(1)最简式是各原子个数的最简单的整数比;
(2)由质谱图可得相对分子质量;结合核磁共振氢谱和红外光谱可知有机物的结构;
(3)1mol此有机物含2mol羟基;
(4)乙二醇被催化氧化为乙二醛.
解答 解:根据质谱图可知,此有机物的相对分子质量为62.故6.2gA的物质的量为0.1mol,设其分子式为CxHyOz.
取6.2g A即0.1molA完全燃烧,将生成的产物经浓硫酸吸收后通过碱石灰.经称量得知,浓硫酸增重5.4g为的水的质量,故生成的水的物质的量n=$\frac{5.4g}{18g/mol}$=0.3mol,碱石灰增重8.8g为二氧化碳的质量,故生成的二氧化碳的物质的量n=$\frac{8.8g}{44g/mol}$=0.2mol.
根据H原子守恒可知:0.1y=0.6,解得x=6
根据燃烧过程中C原子守恒可知:0.1x=0.2,解得y=2.
由于此有机物的相对分子质量为62,故有:12×2+1×6+16z=62,解得z=2.
故此有机物的分子式为C2H6O2.
(1)由于最简式是各原子个数的最简单的整数比,故此有机物的最简式为CH2O,故答案为:CH2O;
(2)由质谱图可知有机物的相对分子质量为62;此有机物的分子式为C2H6O2;根据分子式可知,此符合醇或醚的通式,而根据核磁共振氢谱只有2组峰,红外光谱显示其结构中含有O-H键,故此有机物不是醚,而是醇,且必须是乙二醇,结构简式为:HOCH2CH2OH,故答案为:62;C2H6O2;HOCH2CH2OH;
(3)1mol此有机物含2mol羟基,和金属钠反应的化学方程式为:HOCH2CH2OH+2Na→NaOCH2CH2ONa+H2↑,故1mol乙二醇最多能和2mol金属钠反应,故答案为:2;
(4)乙二醇被催化氧化为乙二醛,化学方程式为:HOCH2CH2OH+O2$→_{△}^{Cu}$OHCCHO+2H2O,故答案为:HOCH2CH2OH+O2$→_{△}^{Cu}$OHCCHO+2H2O;
点评 本题主要考查了有机物分子式、结构简式的确定和化学方程式的书写,难度不大,根据课本知识即可完成.


科目:高中化学 来源: 题型:解答题
 ,C离子的电子排布式为1s22s22p63s23p6
,C离子的电子排布式为1s22s22p63s23p6查看答案和解析>>
科目:高中化学 来源: 题型:填空题
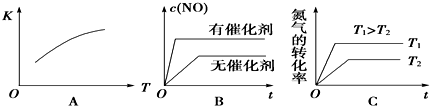
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是甲烷燃料电池原理示意图,回答下列问题:
如图是甲烷燃料电池原理示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水--棕色瓶、阴凉处 | B. | 氢氟酸--橡皮塞、玻璃瓶 | ||
| C. | 少量金属钠--广口瓶、煤油里 | D. | 稀盐酸--细口瓶、阴凉处 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .物质K的结构简式
.物质K的结构简式 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com