
| A. | 铅蓄电池充电时,阳极的反应为:PbSO4+2H2O+2e-═PbO2+SO42-+4H+ | |
| B. | FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| C. | 常温下将5mL 0.1 mol/LNa2S2O3溶液、5mL 0.01 mol/LNa2S2O3溶液分别与5mL 0.1 mol/LH2SO4溶液混合并搅拌,通过记录溶液中出现浑浊的时间,可确定浓度对化学反应速率的影响 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
分析 A.充电时,阳极上失电子发生氧化反应;
B.3FeCl2+2K3[Fe(CN)6]=6KCl+Fe3[Fe(CN)6]2↓,反应后Fe3[Fe(CN)6]2为蓝色沉淀;
C.浓度不同,反应速率不同;
D.HgS的溶解度很小.
解答 解:A.充电时,阳极上电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故A错误;
B.FeCl2溶液与K3[Fe(CN)6]溶液混合后发生3FeCl2+2K3[Fe(CN)6]=6KCl+Fe3[Fe(CN)6]2↓,溶液由浅绿色生成蓝色沉淀,可检验,故B正确;
C.Na2S2O3溶液浓度不同,在酸性条件下生成沉淀的时间不同,可用来比较反应速率大小,故C正确;
D.HgS的溶解度很小,可用硫化钠处理含有Hg2+离子的废水,故D正确.
故选A.
点评 本题综合考查化学实验方案的评价,涉及电解原理、物质的检验以及反应速率因素的探究等知识,题目难度不大,注意A项,为易错点.


科目:高中化学 来源: 题型:解答题
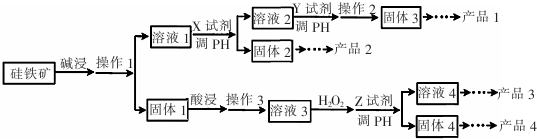
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2═Ca2++2Cl- | B. | H2SO4═2H++SO42- | ||
| C. | CH3COOH═CH3COO-+H | D. | KOH═K++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol•L-1的氨水含有0.1NA个OH- | |
| B. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 在电解精炼粗铜的过程中,当阴极析出32g铜时转移电子数为NA | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40 mL | B. | 72 mL | C. | 128 mL | D. | 20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买的63%浓硝酸,硝酸试剂标签上的部分内容.据此计算
如图是某学校实验室从化学试剂商店买的63%浓硝酸,硝酸试剂标签上的部分内容.据此计算查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的醋酸中:c(H+)=4.0mol•L-1 | |
| B. | 饱和小苏打溶液中:c(Na+)>c(HCO3-) | |
| C. | 饱和食盐水中:c(Na+)+c(H+)=c(Cl-) | |
| D. | pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com