
【题目】A-J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
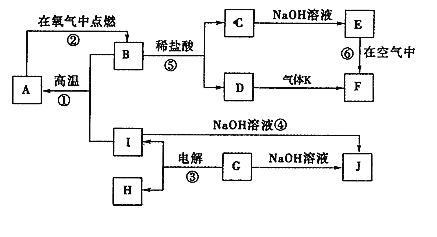
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置_________
(2)写出检验D溶液中阳离子的方法____。
(3)写出反应④的离子方程式________。
(4)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH_____7(填“>”、“<”或“=”),用离子方程式表示其原因:______;
(5)若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是______。
【答案】第四周期Ⅷ族 取少量D溶液,加KSCN溶液,出现红色 2Al+2OH-+2H2O=2AlO2-+3H2↑ < NH4++ H2O![]() NH3·H2O+OH- c(NH4+)> c(SO42-)> c(H+)>c(OH-)
NH3·H2O+OH- c(NH4+)> c(SO42-)> c(H+)>c(OH-)
【解析】
G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明G为Al2O3,与NaOH反应生成NaAlO2,而I也能与NaOH反应生成NaAlO2,则I为Al,H为O2,C和碱、D和气体K反应生成E、F,则说明E、F都为氢氧化物,E能转化为F,应为Fe(OH)2→Fe(OH)3的转化,所以E为Fe(OH)2,F为Fe(OH)3,则C为FeCl2,D为FeCl3,K为NH3,B为Fe3O4,与Al在高温条件下发生铝热反应生成A,即Fe,结合对应单质、化合物的性质解答该题。
(1)A、B、C、D、E、F六种物质中都含有铁元素,在周期表中位于周期表第四周期Ⅷ族,
(2)溶液D为氯化铁溶液,检验三价铁离子的存在,取少许D溶液于试管中,滴加KSCN溶液,溶液变红色,证明D溶液中含有Fe3+;
(3)反应④是金属铝和氢氧化钠溶液的反应,Al与NaOH溶液反应生成NaAlO2和H2,反应的离子方程式为:![]() ;
;
(4)气体K的水溶液为一水合氨溶液,加入盐酸,使其恰好完全反应生成氯化铵和水,氯化铵在水溶液中水解显酸性,所以pH<7;反应的离子方程式为:![]() ;
;
(5)若向气体NH3的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,假设条件均为1L,发生反应:![]() ,n(NH3H2O)=0.1mol,n(H+)=0.1mol,所以一水合氨和硫酸反应生成硫酸铵溶液,铵根离子水解显酸性,溶液中离子浓度大小顺序为:c(
,n(NH3H2O)=0.1mol,n(H+)=0.1mol,所以一水合氨和硫酸反应生成硫酸铵溶液,铵根离子水解显酸性,溶液中离子浓度大小顺序为:c(![]() )>c(
)>c(![]() )>c(H+)>c(OH-)。
)>c(H+)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,可通过如图所示路线合成。A是石油化工的重要产品且分子中所有原子在同一平面内,H的分子式是C7H8。
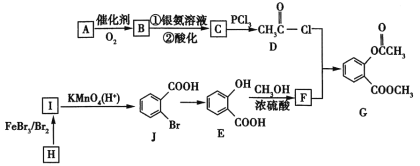
已知:![]() 。
。
回答下列问题。
(1)A的结构简式是___________。
(2)H→I的化学方程式为__________,B与银氨溶液反应的化学方程式是__________。
(3)C→D的反应类型是______,I→J的反应类型是______。
(4)两个E分子在一定条件下发生分子间脱水生成一种环状酯的结构简式是_______________。
(5)满足以下条件的F的同分异构体(不含F)共有_________种。
①能与氯化铁溶液发生显色反应 ②分子中有—COO—结构 ③苯环上有两个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将图象中相应的数字序号填入表中的顺序为
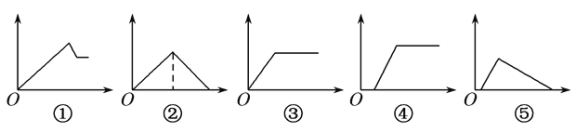
溶液 | 加入物质 | 相应序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和澄清石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合溶液 | 逐滴加入NaOH溶液至过量 |
A. ①③②④⑤ B. ③⑤④②①
C. ①②③④⑤ D. ③②④⑤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O42H2O工艺流程如下
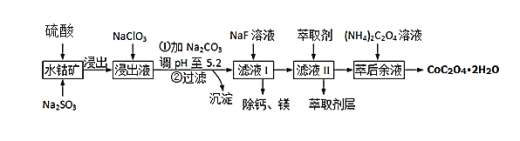
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
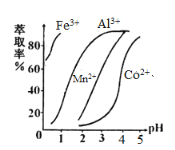
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O42H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.00molL-1NaOH溶液滴入20.00mL1.00molL-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示:
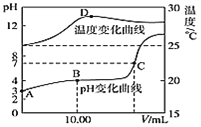
(1)计算室温时20.00mL1.00molL-1的一元酸HA的电离度α=________
(2)图中B点所示的溶液中所含各离子浓度由大到小的顺序是_________
(3)下列说法正确的是_______(填相应序号).
A.由图中可知NaOH和HA反应的![]() H>0
H>0
B.图中C点所加NaOH溶液的体积V=20.00mL
C.图中C点时溶液的KW略大于1×10-14molL-1,溶液中c(H+)=1×10-7molL-1
D.图中D点后,溶液温度略下降的主要原因是生成的NaA水解吸热
(4)常温下在20mL0.1molL-1Na2CO3溶液中逐滴加入0.1molL-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示,回答下列问题:
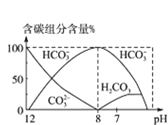
①在同一溶液中,H2CO3、HCO3-、CO32-_________(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒为_______,溶液中各种离子的物质的量浓度的大小关系为______________;
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4molL-1,当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A~H的转换关系如下所示:
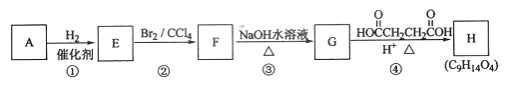
链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,请回答下列问题:
(1)A的结构简式是________;
(2)由F转化为G的化学方程式是_______________________;
(3)G与金属钠反应能放出气体,由G转化为H的化学方程式是_______________;
(4)①的反应类型是___________;③的反应类型是____________;
(5)链烃B是A的同分异构体,分子中的所有碳原子共平面,其催化氢化产物为正戊烷,写出B任一可能的结构简式_______________________________;
(6)C也是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构,则C的结构简式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随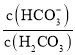 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D.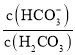 =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二次电池锂离子电池广泛应用于手机和电脑等电子产品中。某常见锂离子电池放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。2018年中国回收了全球可回收锂离子电池总量的69%。但现阶段我国废旧电池回收仍属于劳动密集型产业,效率仍需提高。一种回收该锂离子电池中的锂和钴的流程:
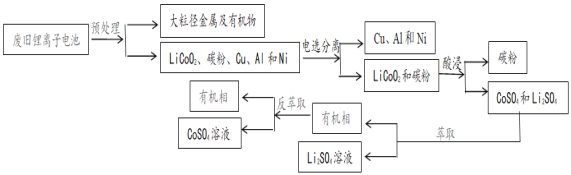
已知:① Na2S2O3是一种中等强度的还原剂,遇强酸分解
② Li2CO3溶解度随温度升高而减小
(1)关于该锂离子电池说法不正确的是_______________________________
A.锂离子电池中无金属锂,充放电过程中,Li+在两个电极之间往返嵌入和脱嵌
B.集中预处理时,为防止短时间内快速放电引起燃烧甚至爆炸,应先进行放电处理
C.充电时若转移0.01mol电子,石墨电极将减重0.07g
D.充电时,阳极的电极反应式为LiCoO2-xe-===Li1-xCoO2+xLi+
(2)LiCoO2是一种具有强氧化性的难溶复合金属氧化物,且Co3+在常温、pH=0.5条件下即开始水解。LiCoO2可溶于硫酸得CoSO4。用硫酸酸浸时,需要加入Na2S2O3作助溶剂,从化学反应原理的角度解释原因:_______________________________,写出浸出CoSO4的离子反应方程式:__________________
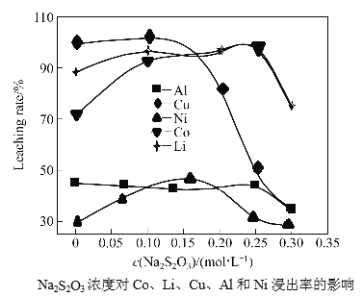
(3)控制氢离子浓度为4mol/L,反应温度90℃,测得相同时间内离子的浸出率与Na2S2O3溶液的变化关系如图。则酸浸时应选用浓度为_______mol/L的Na2S2O3溶液。Na2S2O3溶液浓度增至0.3mol/L时,LiCoO2的浸出率明显下降,可能的原因是_________________(用化学方程式结合文字说明)
(4)整个回收工艺中,可循环使用的物质是_____________________
(5)已知15℃左右Li2CO3的Ksp为3.210-2,该温度下Li2CO3的溶解度约为_____g。将萃取后的Li2SO4溶液加热至95℃,加入饱和Na2CO3溶液,反应10min,________________(填操作)得Li2CO3粉末。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设想利用如图所示的装置生产硫酸,下列有关说法正确的是( )
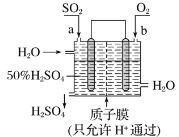
A.a 为正极,b 为负极
B.生产过程中氢离子由右移向左
C.从左下口流出的硫酸的质量分数一定大于 50%
D.负极反应式为 SO2+2H2O-2e-=SO42-+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com