


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)=c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(H+)>c(OH-) D.c(A-)>c(B+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下pH=2的一元弱酸HA溶液,其电离百分率为5%,0.01mol·L-1的一元碱BOH溶液中,![]() =1×1010。将上述两种溶液等体积混合后,得到溶液中各离子浓度大小关系正确的是()
=1×1010。将上述两种溶液等体积混合后,得到溶液中各离子浓度大小关系正确的是()
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)=c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(H+)>c(OH-) D.c(A-)>c(B+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河北省高三上学期第三次考试化学试卷 题型:选择题
常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
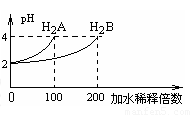
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)=0.01mol /L试卷
C.pH=3的NaHA水溶液中,离子浓度大小为试卷
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为试卷
c(Na+)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:09-10学年浙江舟山七校高二下学期期末考试化学试题 题型:选择题
常温下,取pH=2 的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
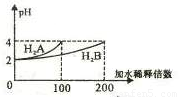
A.H2A为二元弱酸
B.稀释前c(H2B)>c(H2A)=0.01mol /L
C.pH=3的NaHA水溶液中,离子浓度大小为
c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
D.Na2B的水溶液中,离子浓度大小为
c(Na+)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com