
【题目】某原电池装置如图所示,电池总反应为:2Ag+Cl2===2AgCl。下列说法正确的是( )
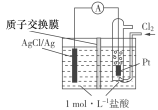
A.正极反应为AgCl+e-===Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

(1)A分子中官能团的名称是 ,D中官能团的名称是________反应①的反应类型是 反应。
(2)反应②的化学方程式是 。
反应④的化学方程式是 。
(3)E是常见的高分子材料,合成E的化学方程式是 。
(4)某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。

① 实验开始时,试管甲中的导管不伸入液面下的原因是 。
②上述实验中饱和碳酸钠溶液的作用是(填字母) 。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
③在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,__________(能/不能)生成1mol 乙酸乙酯,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
![]()
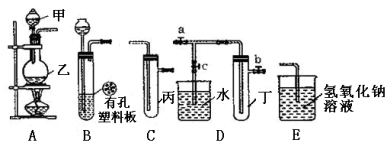
(1)甲、乙两仪器的名称是 、
(2)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式 ,将Cl2通入含有酚酞的NaOH溶液中的现象是 ,该反应的离子方程式为 。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上),可制得NO2并进行有关实验。
①写出该反应的离子方程式 。
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹 ,再打开止水夹 ,使烧杯中的水进入试管丁中。
③试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 mol·L1(保留2位有效数值,气体按标准状况计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
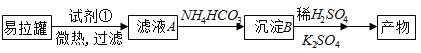
(1)为尽量少引入杂质,试剂①应选用__________(填序号)
A.NaOH溶液 B.H2SO4溶液 C.氨水 D.HCl溶液
(2)易拉罐溶解过程中主要反应的化学方程式为______________;
(3)由滤液A生成沉淀B反应的离子方程式为:_________________;
(4)明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法。某同学用下表所示形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。下列各组中,正确的组合是( )
选项 | 甲 | 乙、丙、丁 |
A | 纯净物 | 液氯、水玻璃、明矾 |
B | 非电解质 | 冰醋酸、SO2、乙醇 |
C | 弱电解质 | CH3COOH 、氨水、H2O |
D | 碱性氧化物 | CaO、Na2O、K2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
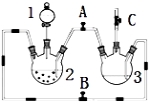
(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关将仪器中的空气排尽后,再关闭开关 、打开开关 ,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由 。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
i滴定过程中发生反应的离子方程式为
ii滴定终点的现象是
iii通过实验数据计算的该产品纯度为 (用字母a,c表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是 (填字母代号 )。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束有气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:
A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为__________ mol/L·
(2)前5min内用B表示的化学反应速率v(B)为___________ mol/(L·min)。
(3)化学方程式中n值为__________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是__________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量 用来衡量一个国家的石油化工发展水平.B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与 氢元素的质量比为12:1,B的相对分子质量为78.回答下列问题:
(1)A的电子式 B的结构简式
(2)A使溴的四氯化碳溶液褪色的化学反应方程式: ,反应类型: ;
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式: ,
反应类型: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com