
【题目】某矿石的主要成分是BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用该矿石制备BaCl2·2H2O的流程如图:

(1)用稀盐酸浸取前需充分研磨矿石,目的是__。
(2)加入NH3·H2O调节pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)要使Ca2+完全沉淀,应控制溶液中的![]() 的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
(4)利用氧化还原滴定法可测定H2C2O4的浓度,取20.00mLH2C2O4溶液于锥形瓶中,用0.10mol/L酸性KMnO4溶液滴定,KMnO4溶液应装在__(填“酸式滴定管”或“碱式滴定管”)中。写出反应的离子方程式为__。滴定终点的现象为__。若滴定达到终点时,消耗KMnO4溶液30.00mL,则H2C2O4溶液的浓度为__mol/L。
【答案】增大接触面积,加快反应效率 Fe3+ Mg(OH)2、Ca(OH)2 2.3×10-4 过量的H2C2O4要结合Ba2+生成BaC2O4沉淀,降低BaCl2·2H2O产率 酸式滴定管 6H++2![]() +5H2C2O4=10CO2↑+2Mn2++8H2O 滴入最后一滴高锰酸钾溶液,溶液由无色变成浅紫色,半分钟无变化 0.375
+5H2C2O4=10CO2↑+2Mn2++8H2O 滴入最后一滴高锰酸钾溶液,溶液由无色变成浅紫色,半分钟无变化 0.375
【解析】
矿石的主要成分是BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加入15%的盐酸反应生成氯化钡、氯化钙、氯化铁、氯化镁,根据离子开始沉淀的pH和完全沉淀的pH值,加入氨水调节pH值,主要除掉铁离子,加入NaOH溶液调节pH=12.5,主要沉淀镁离子和少量钙离子,加入草酸,主要沉淀钙离子,但不能加入过量草酸,过量草酸会沉淀部分的钡离子,导致氯化钡的产率降低。
(1)用稀盐酸浸取前需充分研磨矿石,目的是增大接触面积,加快反应效率;故答案为:增大接触面积,加快反应效率。
(2)根据离子开始沉淀时的pH值和完全沉淀时的pH值,得到加入NH3·H2O调节pH=8可除去Fe3+,滤渣Ⅱ是pH =12.5时完全沉淀了Mg2+,部分沉淀了Ca2+,因此滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;故答案为:Fe3+;Mg(OH)2、Ca(OH)2。
(3)要使Ca2+完全沉淀,![]() ,
,![]() ,因此应控制溶液中的
,因此应控制溶液中的![]() 的浓度不低于2.3×104molL1;同时加入H2C2O4时又应避免过量,原因是过量的H2C2O4要结合Ba2+生成BaC2O4沉淀,降低BaCl2·2H2O产率;故答案为:过量的H2C2O4要结合Ba2+生成BaC2O4沉淀,降低BaCl2·2H2O产率。
的浓度不低于2.3×104molL1;同时加入H2C2O4时又应避免过量,原因是过量的H2C2O4要结合Ba2+生成BaC2O4沉淀,降低BaCl2·2H2O产率;故答案为:过量的H2C2O4要结合Ba2+生成BaC2O4沉淀,降低BaCl2·2H2O产率。
(4)利用氧化还原滴定法可测定H2C2O4的浓度,取20.00mLH2C2O4溶液于锥形瓶中,用0.10 molL1酸性KMnO4溶液滴定,KMnO4溶液是强氧化性溶液,会腐蚀橡皮管,因此应装在酸式滴定管中。高锰酸钾和草酸,在酸性条件下反应生成锰离子、二氧化碳和水,反应的离子方程式为6H++2![]() +5H2C2O4=10CO2↑+ 2Mn2++ 8H2O。滴定终点的现象为滴入最后一滴高锰酸钾溶液,溶液由无色变成浅紫色,半分钟无变化。若滴定达到终点时,消耗KMnO4溶液30.00mL,根据2
+5H2C2O4=10CO2↑+ 2Mn2++ 8H2O。滴定终点的现象为滴入最后一滴高锰酸钾溶液,溶液由无色变成浅紫色,半分钟无变化。若滴定达到终点时,消耗KMnO4溶液30.00mL,根据2![]() ~5H2C2O4,得到n(H2C2O4)=2.5n(
~5H2C2O4,得到n(H2C2O4)=2.5n(![]() )=2.5×0.10 molL1×0.03L=7.5×103mol,则H2C2O4溶液的浓度为
)=2.5×0.10 molL1×0.03L=7.5×103mol,则H2C2O4溶液的浓度为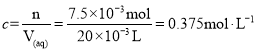 ;故答案为:6H++2
;故答案为:6H++2![]() +5H2C2O4=10CO2↑+2Mn2++8H2O;滴入最后一滴高锰酸钾溶液,溶液由无色变成浅紫色,半分钟无变化;0.375。
+5H2C2O4=10CO2↑+2Mn2++8H2O;滴入最后一滴高锰酸钾溶液,溶液由无色变成浅紫色,半分钟无变化;0.375。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】能正确解释下列反应原理,并且其离子方程式书写正确的是( )
A.泡沫灭火器中Al2(SO4)3和NaHCO3溶液混合:Al3++3HCO![]() =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
B.用小苏打治疗胃酸过多:CO![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.电解MgCl2饱和溶液制取Mg:MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
D.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法生产。气相直接合成的反应为:C2H4(g)+H2O(g)![]() C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
C2H5OH(g) ΔH,乙烯的平衡转化率随温度、压强的变化关系如下图[其中n(C2H4):n(H2O)=1︰1]。
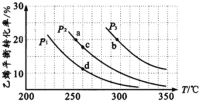
(l)P2时,若起始n(H2O)=n(C2H4)=lmol,容器体积为1L,反应经5 min达到a点,在0~5 min时段,反应速率v(C2H5OH)为____mol/(Lmin),a点的平衡常数Ka=______(保留两位小数)。
(2)乙烯气相直接水合反应的ΔH____0(填“>”或“<”),相同起始量达到a、b所需要的时间ta__tb(填“>”、“<”或“=”,后同)。c、d两点的平衡常数Kc____Kd。
(3)300℃时,要提高乙烯的平衡转化率可采取的措施有______、______ 、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:![]() (橙色)+H2O2
(橙色)+H2O2![]() (黄色)+2H+,用K2Cr2O7溶液进行下列实验:
(黄色)+2H+,用K2Cr2O7溶液进行下列实验:
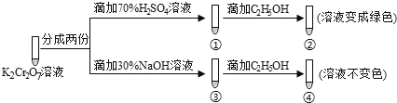
下列说法正确的是
A.①中溶液变黄,③中溶液橙色加深
B.②中![]() 被C2H5OH氧化
被C2H5OH氧化
C.若向④中加入70%H2SO4溶液至过量,溶液变为绿色
D.K2Cr2O7在碱性条件下的氧化性比酸性条件更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是一种治疗缺血性脑卒药物,其合成路线如下:
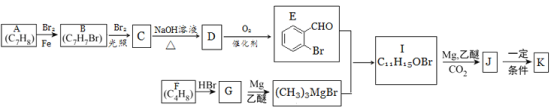
已知:ⅰ.有机物K是一种酯,分子中除苯环外还含有1个五元环;
ⅱ.R—Br ![]() RMgBr
RMgBr 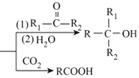
回答下列问题:
(1)有机物B的名称为________,D的含氧官能团的名称是______。
(2)F→G的反应类型为_____。
(3)J的结构简式为______,K的分子式为_____。
(4)E与银铵溶液反应的化学方程式为______。
(5)已知B在一定条件下可以水解生成X,与X互为同分异构体且含有苯环的有机物有_____种(不含X自身),写出其中核磁共振氢谱有4组吸收峰,且峰值比为3:2:2:1的结构简式____(任写一种)。
(6)利用题中信息所学知识,写出以甲烷和苯甲醛为原料,合成苯乙烯的路线流程图(其他试剂自选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.  水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B.  CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌化合物ethuliacoumarionA的结构简式如图所示。下列关于ethuliacoumarionA的说法正确的是

A.分子中有3种含氧官能团
B.分子中有4个手性碳原子
C.能发生银镜反应
D.1mol该化合物与NaOH溶液反应时至多消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NOx、SO2等大气污染物的妥善处理具有重要意义。
CO 还原NO 的脱硝反应:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226 kJ·mol-1
N2(g)+2O2(g) 2NO2(g) △H2=+68 kJ·mol-1
N2(g)+O2(g) 2NO(g) △H3=+183 kJ·mol-1
脱硝反应△H=__________,有利于提高NO 平衡转化率的条件是________________(写出两条)。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) ![]() 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(CO2)=___mol·L-1·min-1。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________(填字母)。
A.加入一定量的粉状碳酸钙
B.适当缩小容器的体积
C.通入一定量的O2
D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气。
有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH= -34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
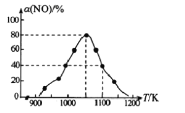
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为______________。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,生成无毒的N2和CO2实验测得,v正=k正c2(NO)·c2(CO),v逆=k逆c(N2) c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅降低温度,k正减小的倍数________(填“>”、“<”或“=”)k逆减小的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为20%,则![]() =________(计算结果用分数表示)
=________(计算结果用分数表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L-1的浓硫酸配制240 mL 4.8 mol·L-1的硫酸,需量取浓硫酸__mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________。(答出两点)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式_________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的ph | 2.7 | — | — | — |
沉淀完全时的ph | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有_______;但溶液的pH不能超过8,其理由是________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com