
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化剂}$2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
分析 A.水的状态应为液体;
B.合成氨的反应为可逆反应,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,而反应物不能完全转化,热化学反应中为完全转化时的能量变化;
C.生成硫酸钙也放出热量;
D.碳酸氢钠完全反应,生成碳酸钡、碳酸钠和水.
解答 解:A.甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,故A错误;
B.500℃、30 MPa下,将0.5 molN2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30Mpa}^{催化剂}$2NH3(g)△H<-38.6 kJ•mol-1,故B错误;
C.HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,生成硫酸钙也放出热量,则H2SO4和Ca(OH)2反应的中和热△H≠2×(-57.3)kJ•mol-1,故C错误;
D.碳酸氢钠溶液中加入过量Ba(OH)2溶液的离子反应为2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O,故D正确;
故选D.
点评 本题考查较综合,涉及热化学反应、可逆反应、中和热及离子方程式的正误判断,把握相关反应原理为解答的关键,试题培养了学生的灵活应用能力,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②③⑤⑥ | C. | 只有①②③⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
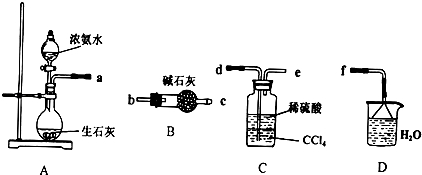 浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4•FeSO4•6H2O]比绿矾(FeSO4•7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
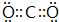 .
.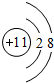 ,D、E结合形成的化合物的电子式
,D、E结合形成的化合物的电子式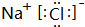 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO4-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 配制该溶液时,将FeBr2粉末溶解在HBr溶液中,并加入少量铁钉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、$S{O_4}^{2-}$、$HC{O_3}^-$ | B. | Cu2+、K+、$S{O_4}^{2-}$、$N{O_3}^-$ | ||
| C. | Na+、K+、Cl-、$S{O_4}^{2-}$ | D. | Fe2+、K+、$N{O_3}^-$、$C{H_3}CO{O^-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与NaOH反应:OH-+H+→H2O | |
| B. | 硝酸溶液和碳酸氢钠反应:H++2CO32-→CO2↑+H2O | |
| C. | 将溴水加入KI溶液中:Br2+2I-→I2+2Br- | |
| D. | CO2通入澄清石灰水:2OH-+CO2→H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.3 kJ•mol-1 | |
| C. | 2CO(g)+1O2(g)═2CO2(g)△H=-566 kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com