
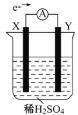
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
 .
.
A. 外电路的电流方向为:X→导线→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
科目:高中化学 来源: 题型:
【题目】化合物D具有抗病毒作用,如图是利用Heck反应合成D的一种路线。
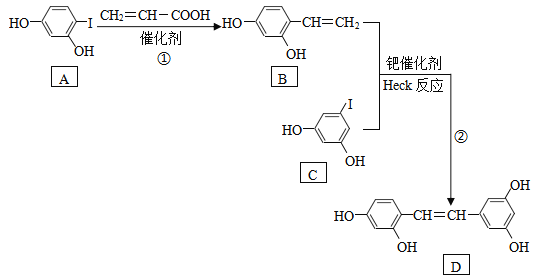
已知Heck反应:R1-X+R2-CH=CH2![]() R1-CH=CH-R2+HX
R1-CH=CH-R2+HX
完成下列填空:
(1)反应①的反应类型是:____________反应。
(2)丙烯酸(CH2=CH-COOH)中官能团的名称是:____________。
(3)写出苯环上只有一个侧链且含-COO-的B的所有同分异构体的结构简式:____________。
(4)利用Heck反应,由苯和乙苯(![]() )为原料制备
)为原料制备![]() ,写出合成路线。(无机试剂任选)_______________________(合成路线的表示方式为:
,写出合成路线。(无机试剂任选)_______________________(合成路线的表示方式为:![]() )。
)。
(5)工业上可用丙烯氧化法生产丙烯酸(CH2=CH-COOH),得到的丙烯酸中往往混有丙烯醛(CH2=CH-CHO)。
①制备过程中,证明已有丙烯酸生成的方法是:____________。
②证明生成的丙烯酸中混有丙烯醛的方法是:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备气体和验证气体性质的装置图。
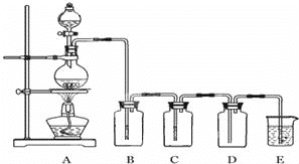
若利用如图装置实现碳和浓硫酸的反应,并进行如下验证:
①装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则D装置中品红溶液的作用是______,证明气体中有CO2的现象是______。
②若证明SO2具有氧化性,同时证明碳酸的酸性比硅酸的强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。
则:B中的现象______,E中应加入______溶液,E中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些电影、电视剧中的仙境美轮美奂,这些神话仙境中所需的烟雾是用化学方法制得的。方法是向放在温热石棉网上的混合物(NH4NO3和Zn粉)中滴几滴水 ,立即看到白烟。该反应的方程式为:NH4NO3+Zn=ZnO+N2↑+2H2O,下列有关说法中正确的是
A.该反应中NH4NO3只作氧化剂
B.常温常压下每消耗1.3gZn粉,该反应可产生448mL N2
C.常温常压下每生成1mol N2,该反应共转移8 mol电子
D.N2既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:

实验I:将Fe3+转化为Fe2+
(1)Fe3+与Cu粉发生反应的离子方程式为:_________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL____mol/LCuSO4溶液向其中滴加3滴0.1mol/LKSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
步骤2:取______________,向其中滴加3滴0.1mol/LKSCN溶液 | 无明显现象 |
查阅资料:ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-=2CuI↓+I2
则Cu2+与SCN-反应的离子方程式为________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色 消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因____________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应;反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ_______(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):

请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以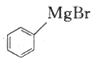 、
、 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。
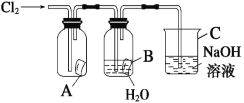
(1)通Cl2一段时间后,A中观察到的现象是_______________,B中观察到的现象是_______________,写出有关反应的化学方程式:_____________________________。
(2)C装置的作用是_____________________________,理由是_______________,写出有关反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com