
����Ŀ�������������������ճ�������������Ҫ�����á�
(1)�о���������200����ѹǿ����200MPaʱ����ʹ�ô������������˳���ϳɡ�����ҵ�Ϻϳ�NH3�������¶�500��ѹǿ20~50MPa�������½��У���֪�ϳɰ�Ϊ���ȷ�Ӧ���Է���ԭ��_____________��
(2)��ҵ�ϳ�����4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)�������ᡣ��ͬ�������£���2L�ķ�Ӧ�����г���2mol NH3��2.75molO2��ƽ��ʱNH3ת����Ϊ50%������¶���K=___�������¶Ȳ��䣬����ѹǿ����ƽ�ⳣ��_____(����������������С������������)�������������䣬���д�ʩһ������������ת���ʵ���____��
4NO(g)+6H2O(g)�������ᡣ��ͬ�������£���2L�ķ�Ӧ�����г���2mol NH3��2.75molO2��ƽ��ʱNH3ת����Ϊ50%������¶���K=___�������¶Ȳ��䣬����ѹǿ����ƽ�ⳣ��_____(����������������С������������)�������������䣬���д�ʩһ������������ת���ʵ���____��
A�����Ͱ���Ũ�� B������������� C�������¶� D���Ƴ�ˮ���� E��ѡ����ʵĴ���
(3)��֪��A��2NH3(g)+CO2(g)NH2COONH4(l) ��H=-123kJ/mol
B��NH2COONH4(l)(NH2)2CO(g)+H2O(g) ��H= +50kJ/mol
���ڹ�ҵ�����У�������������A��B�����ϳɵģ���ҵ���ɰ����������̼�ϳ����ص��Ȼ�ѧ��Ӧ����ʽΪ��_______________��
�����غϳɹ�����ͨ�������¶ȡ�NH3��CO2�����ʵ�����(��̼��a)�����������CO2��ת���ʡ���ͼ������������һ������ͬ��̼��������CO2ƽ��ת�������¶ȵĹ�ϵͼ����ͼ��֪���¶�һ��ʱ��aֵԽ��CO2ת����Խ����ԭ����______����aһ��ʱ��CO2ƽ��ת���ʳ�����������С�����ƣ���ԭ��Ϊ_______��
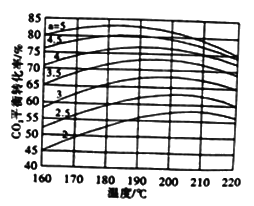
���𰸡��¶�̫�ͷ�Ӧ̫����ѹǿ̫����豸Ҫ��ϸߣ�ѹǿ̫��ת�����½� 0.75 ���� ABD 2NH3(g)+CO2(g)(NH2)2CO(g) +H2O(g) ��H=-73kJ/mol aֵԽ��NH3ռ��Ӧ������ߣ�ƽ���������ƶ������CO2ת���� ǰ���B��ӦΪ�������أ��¶����ߣ��ٽ�B��Ӧ�������ƶ�������A��ӦΪ�������أ�A��Ӧ�������ƶ�
��������
(1)�ϳɰ�Ϊ���������С�ķ��ȷ�Ӧ����Ӱ�췴Ӧ���ʺ�ƽ���ƶ������ط����ϳɰ���Ӧ������������ѡ��
(2)���ݸ����ʵ���ʼ���Ͱ�����ת���ʣ��������ʽ����������ʵ�ƽ��Ũ�ȣ��Ӷ�������÷�Ӧ��ƽ�ⳣ����ƽ�ⳣ�����¶ȵĺ������ݴ˷���ѹǿ��ƽ�ⳣ����Ӱ�죻����Ӱ��ƽ���ƶ������ؽ��з�������ת���ʵı仯�����
(3)�ٸ��ݸ�˹���ɽ��м��㣻
��ǰ���B��ӦΪ�������أ��¶����ߣ��ٽ�B��Ӧ�������ƶ�������A��ӦΪ�������أ�A��Ӧ�������ƶ����ݴ˽��з�����
(1)�ϳɰ���ȻΪ���ȷ�Ӧ�������¶�̫�ͷ�Ӧ̫������λʱ���ڵ�ת���ʵͣ��÷�ӦΪ�����С�ķ�Ӧ��ѹǿ̫��ת�����½�����ѹǿ̫�߶��豸Ҫ��ϸߣ�����ѡ��500��ѹǿ20~50MPa��������
(2)��ʼͶ��Ϊ2mol NH3��2.75molO2��ƽ��ʱNH3ת����Ϊ50%����ƽ��ʱ��n(NH3)=1mol�����ݷ�Ӧ����ʽ��֪��n(O2)=1.25mol����n(NO)=1mol����n(H2O)=1.5mol����ƽ��ʱ��λ�����ʵ���Ϊn(NH3)=(2-1)mol�� n(O2)=(2.75-1.25)mol��n(NO)=1mol��n(H2O)=1.5mol�����������Ϊ2L����NH3�� O2��NO��H2O��Ũ�ȷֱ�Ϊ0.5mol/L��0.75mol/L��0.5mol/L��0.75mol/L��ƽ�ⳣ��K=![]() =0.75��
=0.75��
�¶Ȳ���ƽ�ⳣ�����䣬���Ա����¶Ȳ��䣬����ѹǿ����ƽ�ⳣ�����䣻
A�����Ͱ���Ũ�ȣ��൱������������Ũ�ȣ�������ת��������A�������⣻
B�������������ѹǿ��С���÷�ӦΪ����ϵ��֮������ķ�Ӧ������ƽ��������ƶ���������ת��������B�������⣻
C���÷�Ӧ�ʱ�δ֪�����ж��¶ȶ�ƽ���Ӱ�죬��C���������⣻
D���Ƴ�ˮ��������ʹƽ�������ƶ���������ת��������D�������⣻
E������ֻ�ı䷴Ӧ���ʣ����ı䷴Ӧ��ƽ�⣬������ת���ʲ��䣬��E���������⣻
��������ѡABD��
(3)����֪A��2NH3(g)+CO2(g)NH2COONH4(l)��H=-123kJ/mol
B��NH2COONH4(l)(NH2)2CO(g)+H2O(g)��H= +50kJ/mol
���ݸ�˹����A+B�ɵ�2NH3(g)+CO2(g)(NH2)2CO(g) +H2O(g) ��H=-123kJ/mol+50kJ/mol=-73kJ/mol��
��aֵԽ��NH3ռ��Ӧ������ߣ�ƽ���������ƶ������CO2ת���ʣ�ǰ���B��ӦΪ�������أ��¶����ߣ��ٽ�B��Ӧ�������ƶ�������A��ӦΪ�������أ�A��Ӧ�������ƶ�������CO2ƽ��ת���ʳ�����������С�����ơ�


 ��Ȥ������ҵ���ϿƼ�������ϵ�д�
��Ȥ������ҵ���ϿƼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����10mLNaOH��Һ����μ���0.lmol/L��HR��Һ����÷�Ӧ���Һ��cˮ(OH��)��V(HR)�ı仯��ϵ��ͼ��ʾ������˵������ȷ����
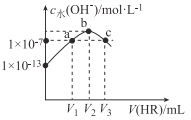
A. V2=10
B. HR����
C. ��V(HR)=V2ʱ����Һ�д��ڣ�c (OH��)��c(H+)=c(HR)
D. ��V(HR)=V1��V3ʱ����Һ�о��У�c(Na+)=c(HR)+c(R��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú����ȼú�糧�ų�����Ҫ�������ҹ���糧��ú�ҵ���Ҫ���������Ϊ![]() ��
��![]() ��CaO�ȣ�һ�����÷�ú����ȡ�������Ĺ����������£�
��CaO�ȣ�һ�����÷�ú����ȡ�������Ĺ����������£�

(1)��ú����ĥ��Ŀ����____________��
(2)��1�ι���ʱ��������Ҫ�ɷ���____________![]() �ѧʽ����ͬ
�ѧʽ����ͬ![]() ��____________����3�ι���ʱ�����ijɷ���____________
��____________����3�ι���ʱ�����ijɷ���____________
(3)��![]() �������ȡʱ�����Ľ�ȡ����ʱ��Ĺ�ϵ��ͼ1�����˵Ľ�ȡʱ��Ϊ____________h�����Ľ�ȡ����
�������ȡʱ�����Ľ�ȡ����ʱ��Ĺ�ϵ��ͼ1�����˵Ľ�ȡʱ��Ϊ____________h�����Ľ�ȡ���� �Ĺ�ϵ��ͼ2��ʾ���ӽ�ȡ�ʽǶȿ��ǣ��������ܼ�
�Ĺ�ϵ��ͼ2��ʾ���ӽ�ȡ�ʽǶȿ��ǣ��������ܼ�![]() F��KF��
F��KF��![]() ��KF�Ļ�����
��KF�Ļ����� ��ͬʱ����ȡ����ߵ���____________
��ͬʱ����ȡ����ߵ���____________![]() �ѧʽ
�ѧʽ![]() ���ú����Ļ��������������ܼ���ȱ����____________
���ú����Ļ��������������ܼ���ȱ����____________![]() ��һ��
��һ��![]() ��
��

(4)������ѭ��ʹ�õ�������____________��____________![]() �ѧʽ
�ѧʽ![]()
(5)�������ܽ����������壬��ͨ��HCl���壬����![]() ���ù����ܹ�������ԭ����____________
���ù����ܹ�������ԭ����____________
(6)�÷�ú����ȡ�������������Ҫ������____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�����
(1)ij�����ķ�����Ϊ 72����������Ӧ���ɵ�һ�ȴ���ֻ��һ�֣��������Ľṹ��ʽΪ_______������Ϊ________________��
(2) ������
������![]() ϵͳ������
ϵͳ������![]() _________��
_________��
(3)��![]() ��ת�������У������ķ�Ӧ����������____________��
��ת�������У������ķ�Ӧ����������____________��
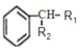
(4)�Ҵ�������������ȩ����ȩ�뻷������( )��Ϊ_________��
)��Ϊ_________��
(5)��֪������������������¿�ת��Ϊ����(C3H6O3)��������Cu������ʱ�ɱ������ɱ�ͪ��( )����������ʵ��֪����Ľṹ��ʽΪ_________�����������۷�Ӧ���ɵĸ߷��ӻ�����Ľṹ��ʽΪ________________��
)����������ʵ��֪����Ľṹ��ʽΪ_________�����������۷�Ӧ���ɵĸ߷��ӻ�����Ľṹ��ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
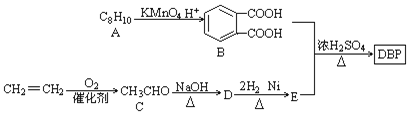
����Ŀ�����ܼ�(�ֽ��ܻ���)��һ���������������ԡ����Եȵ����Ӽ�����������ʳƷ���������ҵ��DBP(�ڱ������������)�����ܼ���һ�֣���������·�ߺϳɣ�
��֪������Ϣ��
��
![]()
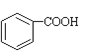
��R2CHO+R2CH2CHO![]()
![]()
(-R1��-R2��ʾ��ԭ�ӻ�����)
(1)A�Ľṹ��ʽ ______��D��E�ķ�Ӧ���� __________��
(2)DBP�ķ���ʽΪ __________��D�Ľṹ��ʽ�� ___________��
(3)��B��E�����ʵ�����1��2�ϳ�DBP�Ļ�ѧ����ʽ�� ________��
(4)д��ͬʱ��������������B������ͬ���칹��ṹ��ʽ __________��
���ܺ�NaHCO3��Һ��Ӧ����CO2�����ܷ���������Ӧ
����ʹFeCl3��Һ������ɫ��Ӧ���ܱ����Ϻ�̼���Ŵ��ڶ�λ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤��һˮ�ϰ���������ʣ��ס��ҡ�����λͬѧ���������Լ�����ʵ�飺
0.10 mol��L��1��ˮ��NH4Cl���塢����茶��塢��̪�Լ���pH��ֽ������ˮ��
(1)�����£�pH=10�İ�ˮ�У�c(OH��)=___����ˮ���������Ũ��Ϊc(OH��)ˮ=_____��
(2)����pH��ֽ���0.10 mol��L��1��ˮ��pHΪ10���ݴ����϶�һˮ�ϰ���������ʣ�����Ϊ��һ����______(������ȷ����������ȷ��)����˵������__________________��
(3)��ȡ��10 mL 0.10 mol��L��1��ˮ������2�η�̪��Һ���Էۺ�ɫ��ԭ����(�õ��뷽��ʽ�ش�)��______���ټ���CH3COONH4������������ɫ��dz��ԭ���ǣ�__________������Ϊ��һ�����ܷ�֤��һˮ�ϰ���������ʣ�_____(����������������)��
(4)��ȡ��10 mL 0.10 mol��L��1��ˮ����pH��ֽ�����pHΪa��Ȼ��������ˮϡ����1 000 mL������pH��ֽ�����pHΪb������ΪֻҪa��b�������¹�ϵ__________(�õ�ʽ��ʽ��ʾ)�Ϳ���ȷ��һˮ�ϰ���������ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ��K=![]() =1.75��10-5������K�Ǹ��¶���CH3COOH�ĵ���ƽ�ⳣ��������˵����ȷ���ǣ� ��
=1.75��10-5������K�Ǹ��¶���CH3COOH�ĵ���ƽ�ⳣ��������˵����ȷ���ǣ� ��
A.�����Һ�м���һ���������ᣬK����
B.�����¶ȣ�K����
C.��CH3COOH��Һ�м�������ˮ��K����
D.��CH3COOH��Һ�м�����������������Һ��K����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(BCl3)��һ����Ҫ�Ļ���ԭ�ϡ�ʵ�����Ʊ�BCl3��ԭ��B2O3+3C+3Cl2 =2BCl3+3CO��ijʵ��С�����ø��������������װ�ã�װ�ÿ��ظ�ʹ�ã��Ʊ�BCl3����֤��Ӧ����CO���ɡ���֪��BCl3���۵�Ϊ-107.3�棬�е�Ϊ12.5�棬��ˮˮ������H3BO3��HCl����ش��������⣺
��ʵ����Ʊ�BCl3����֤����CO
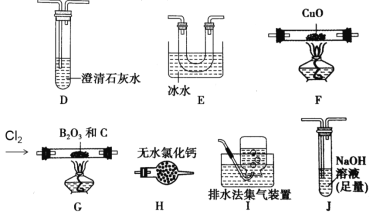
(1)��ʵ��װ���к���������˳��ΪG��_____��_____��_____��____��F��D��I������װ��E��������___________________________��
(2)װ��J�з�Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��ʵ���Ʒ���Ⱥ����IJⶨ
��ȷ��ȡ����m�˲�Ʒ����������ˮ����ȫˮ�⣬�����100mL��Һ��
��ȡ10.00mL��Һ����ƿ��
�ۼ���V1mLŨ��ΪC1 mol/LAgNO3��Һʹ��������ȫ�����������м�����������������ҡ����
����������Ϊָʾ������C2 mol/L KSCN����Һ�ζ�������AgNO3��Һ��������Ӧ��Ag+ +SCN- =AgSCN����
���ظ������~�ܶ��Σ��ﵽ�ζ��յ�ʱ��ȥKSCN��Һ��ƽ�����ΪV2 mL��
��֪: Ksp(AgCl)>Ksp(AgSCN) ��
(3)������дﵽ�ζ��յ������Ϊ__________________��
(4)ʵ������м�����������Ŀ����___________________��
(5)��Ʒ����Ԫ�ص���������Ϊ_________________%��
(6)���в��������������ò�Ʒ���Ⱥ���ƫ����__________��
A.��������������
B.�����������100mL��Һʱ������ʱ���ӿ̶���
C.��KSCN��Һ�ζ�ʣ��AgNO3��Һʱ���ζ�ǰ�����ݣ��ζ���������
D.�ζ�ʣ��AgNO3��Һʱ��KSCN��Һ�ε���ƿ����һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£��� 2 L�ܱ������м���1 mol NO(g)��1 mol����̿(C)��������Ӧ:2NO(g)+C(s) ![]() N2(g)+CO2(g)����H=-213.5 kJ��mol-1���ﵽƽ��ʱ���������¡�
N2(g)+CO2(g)����H=-213.5 kJ��mol-1���ﵽƽ��ʱ���������¡�
�¶�/�� | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
����˵������ȷ���ǣ� ��
A.������Ϣ����֪:t1<t2
B.t1�� ʱ���÷�Ӧ��ƽ�ⳣ��K=![]()
C.t2�� ʱ������Ӧ��ƽ�������С�������ݻ���c(N2)��c(NO)����
D.t1�� ʱ������ʼʱ��Ӧ�����������Сһ�룬ƽ���NO��ת���ʼ�С
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com