
【题目】25℃时,向10mLNaOH溶液中逐滴加入0.lmol/L的HR溶液,测得反应混合液中c水(OH-)与V(HR)的变化关系如图所示。下列说法不正确的是

A. V2=10
B. HR为弱酸
C. 当V(HR)=V2时,溶液中存在:c (OH-)-c(H+)=c(HR)
D. 当V(HR)=V1或V3时,溶液中均有:c(Na+)=c(HR)+c(R-)
【答案】D
【解析】
从图像分析可知,氢氧化钠溶液未加入HR时溶液呈碱性,抑制水的电离,水中电离的c(OH-)=1×10-13,即pH值为13,c(NaOH)=0.1mol/L,当加入HR到体积V1时,水电离的c(OH-)=1×10-7,即溶液中的溶质为NaOH和NaR,NaOH电离出OH-抑制水的电离,而R-水解促进水的电离,使抑制电离和促进电离程度相同,达到a点,使水电离的c(OH-)=1×10-7;继续向溶液中滴加HR,水电离的c(OH-)继续增大,说明这个过程是促进水的电离的,即R-发生水解,所以HR是弱酸,当HR为V2时,b点溶液的溶质为NaR,溶液只有R-水解促进电离,使c(OH-)达到最大值,再继续加入HR,又逐渐抑制水的电离,所以c(OH-)减小。
A.当HR的体积为V2时,b点溶液的溶质为NaR,即发生化学反应NaOH+HR=NaR+H2O,n(NaOH)=n(HR),由上述分析可知,c(NaOH)=0.1mol/L,V(NaOH)=10mL,c(HR)=0.1mol/L,所以V(HR)=10mL,即V2=10mL,故A正确;
B. 由a点——b点的过程中,继续向溶液中滴加HR,水电离的c(OH-)继续增大,说明这个过程是促进水的电离的,即R-发生水解,所以HR是弱酸,故B正确;
C. 当HR的体积为V2时,b点溶液的溶质为NaR,根据质子守恒可得到c (OH-)=c(HR) +c(H+),故C正确;
D. 当加入HR到体积V1时,水电离的c(OH-)=1×10-7,即溶液中的溶质为NaOH和NaR,c(Na+)一定大于c(HR)+c(R-),故D错误;
故选D。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
A. 该反应的化学平衡常数表达式是K=[c4(C)·c2(D)]/[c3(A)·c2(B)]
B. 0~5 min内A的反应速率为0.24 mol·L-1·min-1
C. 此时B的平衡转化率是40%
D. 增大该体系的压强,平衡向右移动,化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的pH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+2OH--2e-=== ClO-+H2O
C. 阴极附近碱性增强,阳极附近碱性减弱
D. 除去CN-的反应:5ClO-+2CN-+2H+ === N2↑+2CO2↑+5Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:

(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=_______________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
A.CO的转化率将增大 B.达到新平衡时的反应热ΔH > —Q
C.气体的密度将不变 D.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g)
2NH3(g)
①达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
A.6 molH2 + 4 molN2
B.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
C.3 molH2+ 1 molN2 + 2 mol NH3
② 若是在恒温恒容的容器中反应,达到平衡时NH3的浓度为c1 mol·L-1,则c________c1(填“<”“>”或“=”),原因是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如下图所示装置进行有关实验。

(1)此装置中,怎样检查除启普发生器之外的装置的气密性?_________________________________。
(2)请完成该实验的有关操作步骤。
①检查装置气密性;
②打开a、b产生氢气,观察试管内物质的颜色变化;
③____________________________________________________;
④加热过氧化钠,观察试管内物质的颜色变化;
⑤反应完全后,__________________________________________;
⑥拆卸装置。
(3)该装置中,碱石灰的作用是_________________________ 。
(4)实验过程中观察到(2)中步骤②无明显变化,步骤④Na2O2熔化后,黄色粉末立即变成白色,干燥管内硫酸铜未变成蓝色。则Na2O2与H2反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有相同氧原子数的二氧化硫和三氧化硫,物质的量之比是___,质量之比是___。把4mol/LCuSO4和2mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和),求混合溶液中C(CuSO4)=_____mol/L,C(SO42-)=___mol/L。将10毫升2mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为____毫升。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液面左边低于右边,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
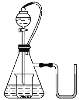
A.过氧化钠B.氧化钠C.钠D.氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是

A. 正反应的活化能等于逆反应的活化能
B. a曲线是加入催化剂时的能量变化曲线
C. 1 mo N2与3 mo H2充分反应放出的热量小于92 kJ
D. 加入催化剂,该反应的焓变减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com