
【题目】(1)现有下列物质①NaCl晶体 ②液态SO2 ③纯醋酸④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 请用以上物质回答下列问题(填序号)。
在上述状态下能导电的强电解质是__________________; 属于弱电解质的是________________;属于非电解质,但溶于水后的水溶液能导电的是_________________。
(2)化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-。
NH4++OH-。
①向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同),c(NH4+)______。
②向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同),c(NH4+)_________。
③升高温度,c(OH-)______(填“增大”或“减小”,下同),c(NH4+)___。
【答案】 ⑦ ③ ② 向左 减小 增大 向右 减小 增大 增大 增大
【解析】(1)①NaCl晶体属于强电解质,但不能导电;②液态SO2属于非电解质,但其水溶液能导电;③纯醋酸属于弱电解质,其水溶液能导电;④硫酸钡属于强电解质,但不能导电;⑤铜是单质,既不是电解质也不是非电解质,但能导电;⑥酒精(C2H5OH)属于非电解质,但其水溶液不导电;⑦熔化的KNO3含有自由移动的阴阳离子,所以能导电,且属于强电解质;⑧NaOH溶液含有自由移动的阴阳离子,但属于混合物,既不是电解质也不是非电解质;⑨氨水中含有自由移动的阴阳离子,但属于混合物,既不是电解质也不是非电解质;故答案为:⑦;③;②;
(2)①向氨水中加入氯化铵固体时,铵根离子浓度增大,一水合氨的电离平衡逆向移动,氢氧根离子浓度减小,故答案为:向左;减小;增大;
②向氨水中加入氯化镁固体时,镁离子和氢氧根离子反应生成氢氧化镁沉淀,氢氧根离子浓度减小,促进一水合氨电离,则溶液中铵根离子浓度增大,故答案为:向右;减小;增大;
③升温促进一水合氨的电离,氢氧根离子和铵根离子浓度都增大,故答案为:增大;增大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室常下图装置进行铜跟浓硫酸反应等一系列实验。请回答下列问题
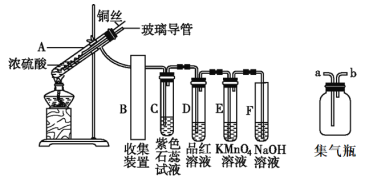
(1)装置B就是右上图的集气瓶,则装置A的导管应连接集气瓶的____(填“a”或“b”)进口;
(2)用装置A制备SO2的优点主要是_________________________。(任答一条即可);
(3)装置A中的反应方程式为______________________________________________;
(4)装置C中的现象是________________;反应结束后加热D中溶液,现象是___________;
(5)装置E中出现的现象可以说明SO2具有__________性;
(6)装置F中的反应的离子方程式为____________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是铁碳合金的总称,其强度高、价格便宜、应用广泛。在以下关于不锈钢和普通钢的认识中,你认为正确的是
A. 它们的组成元素是相同的
B. 耐腐蚀的性能不同
C. 它们都属于钢,因此物理性质相同
D. 构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀。
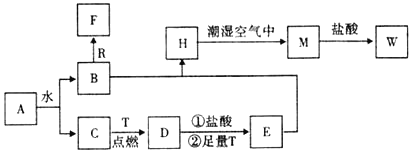
(1)物质A的化学式为_____,F化学式为____________;
(2)B和R在溶液中反应生成F的化学方程式为_____________________________;
(3)H在潮湿空气中变成M的化学方程式为_________________________________;
(4)A和水反应生成B和C的离子方程式为_________________________________;
(5)M投入盐酸中的离子方程式___________________________________________;
(6)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中少量二氧化碳接触,生成了乳白色的凝胶状沉淀的缘故。写出反应的离子方程式____________________________;
(7)小苏打可作胃药,请写出其中和胃酸时的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al片和Cu片用导线连接,一组插入浓硝酸中,一组插入稀NaOH溶液中,分别形成原电池。
(1) 写出插入稀NaOH溶液中形成原电池的负极反应______________。
(2) 写出插入浓硝酸中形成原电池的正极反应_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。
N在元素周期表中的位置:______________。
元素C、N最简单气态氢化物的稳定性强弱比较(填化学式): ____________.
I.氨气应用于侯德榜制碱工艺,原理如下图所示:
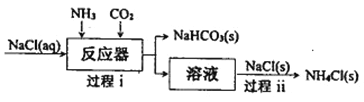
(1)过程i通入NH3和CO2的顺序是___________。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
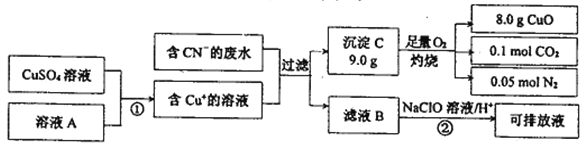
(1)溶液A具有的性质是(填“氧化性”或“还原性”) _______. C的化学式为:______。
(2)反应② 可将CN一转化为无害物质,其离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为amol的Na 和Al一同投入mg足量水中,所得溶液的密度为ρg·cm-3,则此溶液的物质的量浓度为( )
A. 1000aρ/(46a+m)mol·L-1 B. 4ρ/(46a+m)mol·L-1
C. 1000aρ/(50a+m)mol·L-1 D. 1000aρ/(45a+m)mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g·cm-3)配制1 mol·L-1的稀硫酸100 mL。配制过程中可能用到下列仪器:①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按使用先后顺序排列正确的是( )
A. ④③⑦⑤⑥ B. ②⑤⑦④⑥ C. ②⑥③⑦⑤⑥ D. ④③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
I.(1)海水中所得粗盐中通常含Ca2+、Mg2+、SO42-等杂质,为了得到精盐,下列试剂加入的先后顺序正确的是________
A.BaCl2→Na2CO3→NaOH→HCl B.NaOH→BaCl2→Na2CO3→HCl
C.BaCl2→NaOH→Na2CO3→HCl D. Na2CO3→NaOH→BaCl2→HCl
(2)为了检验精盐中是否含有SO42-,正确的方法是____________________________。
II.海藻中提取碘的流程如图所示
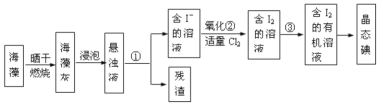
(1)灼烧过程中,需使用到的(除泥三角外)实验仪器有______
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯 F.三脚架
(2)指出提取碘的过程中有关实验操作名称:①________③__________④_________
(3)步骤②反应的离子方程式为___________________,该过程氧化剂也可以用H2O2,将等物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为__________
(4)下列关于海藻提取碘的说法,正确的是_________
A.含碘的有机溶剂呈现紫红色
B.操作③中先放出下层液体,然后再从下口放出上层液体
C.操作④时,温度计的水银球应伸入液面以下但不能触碰到蒸馏烧瓶的底部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com