
【题目】如图为铝热反应的实验装置,请回答下列问题:

(1)该实验装置中还缺________,引发铝热反应的操作为_______。
(2)若将氧化铁换成氧化镁,该反应____(填“能”或“不能”)发生,理由是______。
(3)铝热反应的用途有哪些__________。
【答案】镁条和氯酸钾 在混合物中间插一根镁条,将氯酸钾放在混合物上镁条的周围,点燃镁条 不能 镁比铝活泼,铝不能置换镁 用于焊接钢轨;冶炼某些熔点高的金属
【解析】
(1)利用镁条燃烧放热从而引发铝热反应,同时促使KClO3分解产生O2,使镁条快速燃烧。
(2)根据金属活动顺序表,Mg比Al活泼,Al不能从MgO中置换出Mg。
(1)实验需要的药品主要是镁条、氯酸钾、氧化铁、铝粉、细沙,因此该实验装置中还缺镁条和氯酸钾,引发铝热反应的操作为在混合物中间插一根镁条,将氯酸钾放在混合物上镁条的周围,点燃镁条,故答案为:镁条和氯酸钾;在混合物中间插一根镁条,将氯酸钾放在混合物上镁条的周围,点燃镁条。
(2)铝热反应是铝和金属氧化物(还原性比铝弱的金属氧化物)若将氧化铁换成氧化镁,该反应不能发生,理由是镁比铝活泼,铝不能置换镁,故答案为:不能;镁比铝活泼,铝不能置换镁。
(3)铝热反应的用途有哪些用于焊接钢轨;冶炼某些熔点高的金属,故答案为: 用于焊接钢轨;冶炼某些熔点高的金属。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于我国煤储藏量相对比石油和天然气丰富,能源消费以煤为主。将原煤作为燃料燃烧,既严重污染环境,效率又不高,因而国家大力提倡煤的综合利用。实施“煤变油”,其原理之一是先将煤与水蒸气制得水煤气(一氧化碳和氢气),再催化合成甲醇或烃类等液态能源。
(1)用一氧化碳和氢气合成甲醇的化学方程式是______________________________________。
(2)用一氧化碳和氢气合成烃(CnHm)的化学方程式是__________________________。
(3)气化和液化的优点是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温恒容的密闭容器中,放入一定量的甲醇,发生反应:![]() .以下可以作为该反应达到平衡状态的判断依据为( )
.以下可以作为该反应达到平衡状态的判断依据为( )
A.容器内气体密度保持不变B.气体的平均相对分子质量保持不变
C.![]() 的体积分数保持不变D.
的体积分数保持不变D.![]() 与
与![]() 的物质的量之比保持
的物质的量之比保持![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H)。
化学键 | Cl-Cl | H—H | H—Cl | N≡N |
键能/kJ·mol | 243 | 436 | 431 | 946 |
(1)按要求完成填空
a.2HCl(g) = H2(g)+Cl2(g);△H=______________________
b.N2 (g)+3H2(g)= 2NH3(g) ΔH=-92kJ/mol,则N—H键的键能是__________kJ·mol
(2)1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式__________________________________

(3) 已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2
③ H2O(g) = H2O(l) ΔH3
则CH3OH(l)+O2(g)=CO(g)+ 2H2O(l)ΔH =__________(用含ΔH1、ΔH2、ΔH3的式子表示)
(4)已知:2Al (s)+ 3/2O2(g)==Al2O3(s) △H=-1644.3 kJ mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) △H=-815.88kJ mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用36.5%、密度为1.19g/cm3的浓盐酸配制0.1mol/L的稀盐酸500mL,请回答:
(1)用量筒量取所需浓盐酸的体积为___mL。
(2)实验配制稀盐酸,所用到的玻璃仪器:___、___、___、___、量筒。
(3)如果在配制过程中,第一次加水量太少,搅拌时间较长,导致配制溶液的浓度___(偏大,偏小或不影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)基态K原子中,核外电子占据最高能层的符号是_______,占据该能层电子的电子云轮廓图形状为______________。
(2)已知元素M是组成物质![]() 的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号
的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号![]() 至
至![]() 表示)如表所示:
表示)如表所示:
|
|
|
|
| |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_______
(3)![]() 的中心原子的杂化方式为__________,键角为____________
的中心原子的杂化方式为__________,键角为____________
(4)![]() 中非金属元素电负性由大到小的顺序为_____________
中非金属元素电负性由大到小的顺序为_____________
(5)下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能:![]() B.共价键的极性:
B.共价键的极性:![]()
C.晶格能:![]() D.热稳定性:
D.热稳定性:![]()
(6)如图是![]() 晶胞,构成二氧化硅晶体结构的最小环是由________个原子构成。已知晶胞参数为
晶胞,构成二氧化硅晶体结构的最小环是由________个原子构成。已知晶胞参数为![]() ,则其晶胞密度为________
,则其晶胞密度为________![]() 。
。
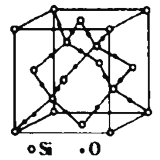
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同体积和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如下图所示。下列说法正确是( )

A.由图可知三种酸的酸性为:HX<HY<HZ
B.在等物质的量浓度的NaX和HX混合溶液中存在:c(H+)-c(OH-)=c(X-)-c(HX)
C.浓度均为0.1mol/L的NaX、NaY、NaZ的混合溶液中:![]()
D.在pH相等NaX和NaY的溶液中存在:c(HX)+c(X-)=c(HY)+c(Y-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com