
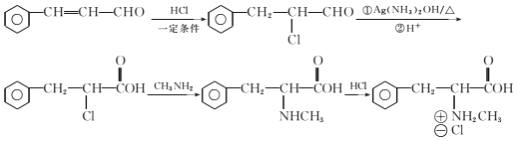
【题目】合成神经抑制剂F的一种路线如图所示:
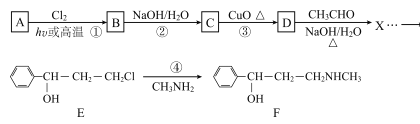
已知:![]()
请回答下列问题:
(1)已知芳香烃A的相对分子质量为92,A的结构简式为____;B的系统命名是___ ;C中含氧官能团的名称是____。
(2)反应③的化学反应方程式为____;①~④中属于取代反应的是____。
(3)D分子中最多有____个原子共平面。
(4)④的反应中,因反应温度控制不当,常常有副产物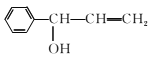 生成,写出可能的副反应方程式____。
生成,写出可能的副反应方程式____。
(5)包含C在内,C的同分异构体中芳香族化合物共有____种,其中满足下列条件同分异构体的结构简式为____。
①能使FeCl3溶液显色,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1。
(6)已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备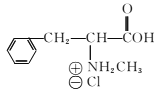 的合成路线(无机试剂自选):________________________________________
的合成路线(无机试剂自选):________________________________________
流程示例:![]()
【答案】 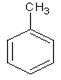 1-氯甲苯 羟基或醇羟基
1-氯甲苯 羟基或醇羟基 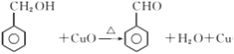 ①②④ 14
①②④ 14 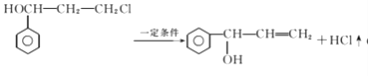 5
5 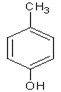
【解析】A为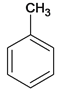 ,光照条件下与氯气在侧链上取代得B
,光照条件下与氯气在侧链上取代得B ,B在氢氧化钠加热条件下水解生成C
,B在氢氧化钠加热条件下水解生成C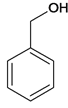 ,C氧化成D
,C氧化成D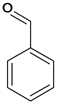 。
。
(1)芳香烃A的相对分子质量为92,92/12=7...8,A的分子式为C7H8,A的结构简式为 ;B
;B 的系统命名是1-氯甲苯 ;C
的系统命名是1-氯甲苯 ;C 中含氧官能团的名称是 羟基或醇羟基;(2)反应③是醇氧化成醛,化学反应方程式为
中含氧官能团的名称是 羟基或醇羟基;(2)反应③是醇氧化成醛,化学反应方程式为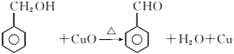 ;①~④中③是氧化反应,属于取代反应的是①②④;(3)D
;①~④中③是氧化反应,属于取代反应的是①②④;(3)D 分子中7C、6H和1个O原子,最多有14个原子共平面。(4)④的反应中,因反应温度控制不当,常常有副产物
分子中7C、6H和1个O原子,最多有14个原子共平面。(4)④的反应中,因反应温度控制不当,常常有副产物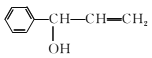 生成,写出可能的副反应方程式
生成,写出可能的副反应方程式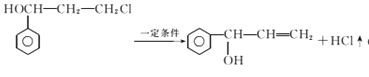
 ;(5)包含C
;(5)包含C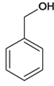 在内,C的同分异构体中芳香族化合物,有邻、间、对甲基苯酚3种,苯甲醚1种,苯甲醇1种,共有5种,其中满足①能使FeCl3溶液显色,有酚羟基,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1条件的结构简式:
在内,C的同分异构体中芳香族化合物,有邻、间、对甲基苯酚3种,苯甲醚1种,苯甲醇1种,共有5种,其中满足①能使FeCl3溶液显色,有酚羟基,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1条件的结构简式:![]() 。(6)已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备
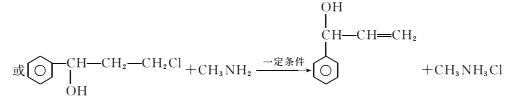
。(6)已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备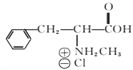 的合成路线:
的合成路线: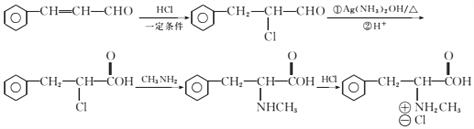 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碲(Te)及其化合物有许多优良性能,被广泛用于冶金、化工等领域。
(1)碲(Te)在周期表中的位置为________________________。碲化氢的还原性比H2S的还原性__________(填“强”或“弱”)。
(2)已知25℃时,亚碲酸(H2TeO3)的电离平衡常数:Ka1=1×10—3,Ka2=2×10—8。
①0.1mol/L H2TeO3溶液中H2TeO3的电离度约为__________;
②已知NaHTeO3的水溶液呈酸性,溶液中所有离子浓度大小顺序为____________________。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含Cu2Te,还含少量Ag、Au)为原料制备单质碲,其工艺流程如图:
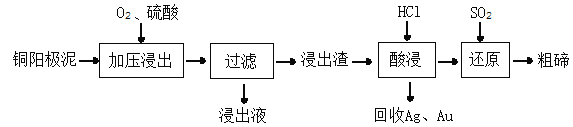
①已知浸出渣的主要成分是TeO2。写出“加压浸出”过程中的离子方程式________________________,该过程中,应控制溶液的pH为4.5~5.0,酸性不能太强的原因是__________________________。
②“酸浸”后将SO2通入浸出液即可制得单质碲,写出生成单质碲的化学方程式______________________。
③工业上还可以将铜阳极泥煅烧生成TeO2,然后碱浸,过滤,再对滤液进行电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的NO3对人类健康会产生危害,为了降低饮用水中NO3的浓度,可以在碱性条件下用铝粉将NO3还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________,还原产物是________。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______mol电子。
(4)请配平下列离子方程式。
____Fe2++____H+ +____NO3=____Fe3+ +____N2O↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是__________________。
(2)实验室可以用铜和稀硝酸反应制取NO,反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑ +4H2O
①该反应中还原剂为__________
②氧化剂与还原剂之比是__________
③如果反应中转移了0.15mol电子,则产生的气体在标准状况下体积为______________
④用双线桥标出该反应转移电子数目情况_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种液态混合物:①乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);②汽油和水;③溴水。在实验室分离这三种混合物的正确方法依次为
A.蒸馏、分液、萃取 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是

A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:
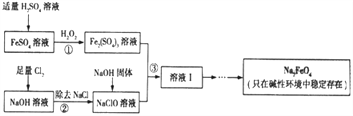
(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O![]() 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O![]() 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。
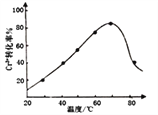
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO![]() ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO![]() +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com