
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠的途径如图所示:
(1) Na2MoO4·2H2O中钼元素的化合价是____________
(2)焙烧过程发生的主要反应为MoS2+O2→MoO3+SO2(未配平),该反应的氧化产物是____________(填化学式)。
(3)碱浸时生成Na2MoO4和一种气体A,该气体的电子式为________;沉淀时加入Na2S溶液的目的是______________________
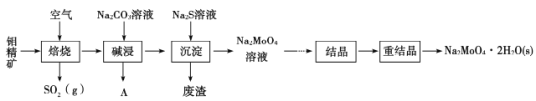
(4)焙烧钼精矿所用的装置是多层焙烧炉,图1为各炉层固体物料的物质的量的百分数(φ)。
第6层焙烧炉中所得MoO3与MoO2的物质的量之比为___________
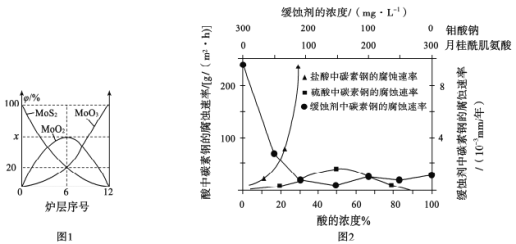
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______。
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是__________________________________。
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成FeMnO4—Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_____________________________
【答案】+6 MoO3和SO2 ![]() 除去Pb2+离子 1:3 1:1 C1-有利于碳钢的腐蚀,SO
除去Pb2+离子 1:3 1:1 C1-有利于碳钢的腐蚀,SO![]() 不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸; 替代空气中氧气起氧化剂作用
不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸; 替代空气中氧气起氧化剂作用
【解析】
(1)~(3)从流程图知:先在空气中灼烧生成MoO3,同时得到对环境有污染的气体SO2,然后再用纯碱溶液溶解MoO3,经过“沉淀”环节除去杂质PbS,即可得到钼酸钠溶液,最后结晶得到钼酸钠晶体;据此分析解答;
(4)~(6)通过读图、从图片中提取有效信息、结合元素守恒、影响速率的可能因素等知识分析、回答;
(1) 根据化合物中元素化合价代数和为0,Na2MoO4·2H2O中钼元素的化合价是+6;答案为:+6;
(2) 焙烧过程中MoS2和O2反应生成MoO3和SO2,Mo元素的化合价从+2价升高到+6价、S元素的化合价从1价升高到+4价,O元素的化合价从0价降低到2价,根据得失电子守恒和原子守恒,配平后的化学方程式为![]() ,该反应的还原剂是MoS2,则氧化产物是MoO3和SO2;
,该反应的还原剂是MoS2,则氧化产物是MoO3和SO2;
答案为:MoO3和SO2;
(3由流程图可知,碱浸时MoO3与Na2CO3反应生成一种气体A和Na2MoO4,可推知碱浸时发生了反应:![]() ,则A为CO2,电子式为
,则A为CO2,电子式为![]() ;流程图中“沉淀时”加入Na2S溶液后再过滤,得到的滤液中已经不含铅元素,则铅元素转移到废渣中,即废渣含PbS,加入Na2S溶液目的是除去Pb2+离子;
;流程图中“沉淀时”加入Na2S溶液后再过滤,得到的滤液中已经不含铅元素,则铅元素转移到废渣中,即废渣含PbS,加入Na2S溶液目的是除去Pb2+离子;
答案为:![]() ;除去Pb2+离子;
;除去Pb2+离子;
(4)第6层焙烧炉中所得含钼元素产物有与MoS2、MoO3与MoO2,其中MoS2与MoO3物质的量百分数均为20%,则MoO2物质的量百分数为60%,则MoO3与MoO2的物质的量之比为1:3;
答案为:1:3;
(5)①根据图像知当缓蚀剂中钼酸钠和月桂酰肌氨酸均为150mg/L时碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为1:1;
答案为:1:1;
②随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异,则二者主要的差别为阴离子不同,可以推测其主要原因是C1-有利于碳钢的腐蚀,SO![]() 不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
答案为:C1-有利于碳钢的腐蚀,SO![]() 不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;
③空气中钼酸盐对碳钢的缓蚀原理是在碳钢表面形成FeMnO4—Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需要加入钼酸盐外还需加入NaNO2。则NaNO2的作用是替代空气中氧气起氧化剂作用,以便在碳钢表面形成FeMnO4—Fe2O3保护膜;
答案为:替代空气中氧气起氧化剂作用。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的二氧化硫气体和二氧化碳气体相比较,下列叙述正确的是( )
A. 体积比1∶1B. 体积比11∶16
C. 分子个数比1∶1D. 密度比11∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,已知∶CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g),下列说法不正确的是( )
CO2(g)+3H2(g),下列说法不正确的是( )
A.0.1 mol CH3OH中含共价键数为0.5NA
B.10.0g 质量分数为32%的CH3OH溶液与4.6g的钠反应,产生H2分子数为0.1NA
C.1 mol CH3OH与足量的H2O反应,得到CO2分子数为NA
D.每消耗0.1 mol CH3OH时,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过硝酸钠(NaNO4)能与水发生反应∶NaNO4+H2O= NaNO3+H2O2,下列说法不正确的是( )
A.过硝酸钠可用于杀菌消毒
B.过硝酸钠中含有-O-O-结构
C.过硝酸钠具有强氧化性,没有还原性
D.将过硝酸钠加入酸性FeSO4溶液中发生的离子方程式∶![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用天然气制取合成气,然后用合成气合成多种有机物是目前部分有机物的重要来源。
I.甲烷制取合成气时,在同一容器中同时发生的主要反应是:
反应①: CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H =+206.3 kJ mol-l
CO(g)+3H2(g) △H =+206.3 kJ mol-l
反应②: CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H =-802.6 kJmol-l
CO2(g)+2H2O(g) △H =-802.6 kJmol-l
(1)下列有关合成气制取的说法中正确的是_____。
A.升温时反应①的正反应速率增大,逆反应速率减小,平衡正向移动
B.反应②因为反应物和生成物的计量数相等,所以△S=0
C.反应②放出的热可以提供反应①所需的热量
D.在恒温恒容容器中,气体密度保持不变时,反应达到化学平衡状态
(2)在制取合成气的初始阶段,反应②的反应速率大于反应①的反应速率,请用碰撞理论解释原因______。
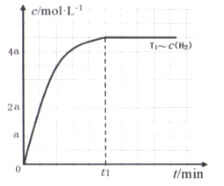
(3)在某密闭容器中加入一定量的CH4、H2O,在温度为T1时发生反应①,t1时达到化学平衡状态,氢气浓度[c(H2)]随时间(t)的变化如图。控制其它条件不变,在温度为T2时(T2<T1)发生反应,在图中画出c(CO)变化曲线_____。
II.合成己烷时发生的反应是∶
主反应:反应③6CO(g)+13H2(g)![]() C6H14(g)+6H2O(g) △H
C6H14(g)+6H2O(g) △H
副反应:反应④CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
反应⑤2CO(g)![]() CO2(g)+C(s)
CO2(g)+C(s)
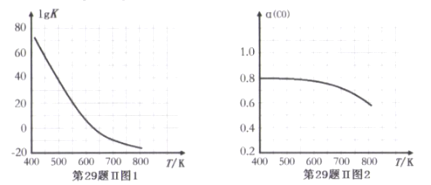
反应③的平衡常数的对数(lgK)随温度(T/K)的变化如图1,在固定的氢碳比[m(H2)/m(CO)]条件下CO的平衡转化率[a(CO)]随温度变化的曲线如图2.
请回答∶
(1)反应③的△H______0 (填“>”“="或“<")
(2) 600K前随温度升高反应③的平衡转化率几乎不变,结合图1说明原因(副反应影响可忽略)_____。
(3)工业生产需要选择适合的条件提高综合效益,下列对工业合成已烷的说法中正确的是(______)
A.减少体系中的水蒸气,有利于提高生产效益
B.在体系中加入并保持一定量的二氧化碳有利于减少副反应的发生
C.在体系中加入并保持一定量的碳有利于工业合成已烷
D.工业生产中,选择的压强越高越有利于提高综合效益
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用下列实验装置或方案能达到实验目的的是
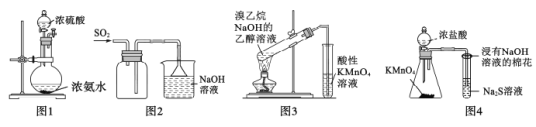
A.用图1装置制备少量氨气
B.用图2所示装置收集SO2
C.用图3所示装置检验是否有乙烯产生
D.用图4装置比较KMnO4、C12、S的氧化性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用高分子吸附树脂提取卤水中的碘(主要以I-形式存在)的工艺流程如下
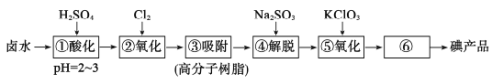
下列说法正确的是
A.流程中①和④所得溶液中,I-离子的浓度相等
B.流程中⑥的分离碘产品的操作方法是萃取
C.流程中④发生离子反应:2I2+SO![]() +H2O=4I-+SO
+H2O=4I-+SO![]() +2H+
+2H+
D.制备10mol I2,理论上需KC1O3的质量约为408g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究原电池产生电流的过程,设计了如图实验。
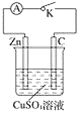
(1)打开K,观察到的现象为________________。
(2)关闭K,观察到的现象是_________。此电池的负极的电极反应式为_____。
(3)关闭K,溶液中阳离子向_______(填“Zn”或“C”)极移动,外电路中,电子流动方向是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3 mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应初始时观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。
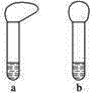
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如上图所示,则试管b中反应的离子方程式为___________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com