
分析 25℃时,NH3•H2O电离出NH4+和OH-而导致溶液中c(OH-)>c(H+),溶液呈碱性;向氨水中加入NH4Cl固体,溶液中c(NH4+)增大而抑制一水合氨电离,据此分析解答.
解答 解:25℃时,NH3•H2O电离出NH4+和OH-而导致溶液中c(OH-)>c(H+),所以溶液呈碱性,电离方程式为NH3•H2O?NH4++OH-;向氨水中加入NH4Cl固体,NH4Cl完全电离导致溶液中c(NH4+)增大而抑制一水合氨电离,一水合氨电离平衡逆向移动,溶液中c(OH-)降低,溶液的pH减小,
故答案为:碱性;NH3•H2O?NH4++OH-;减小;增大铵根离子的浓度,平衡向左移动.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点及影响弱电解质电离因素是解本题关键,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某混合物A,含有Al2(SO4)3、Al2O3、Fe2O3,在一定的条件下可实现如图所示的变化.请回答下列问题:
某混合物A,含有Al2(SO4)3、Al2O3、Fe2O3,在一定的条件下可实现如图所示的变化.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 比值$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
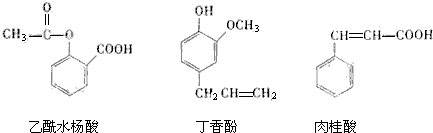
| A. | ②与① | B. | ③与④ | C. | ①与④ | D. | ②与④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体带有电荷 | |
| C. | 用聚光手电筒照射FeCl3溶液和Fe(OH)3胶体时,产生的现象相同 | |
| D. | Fe(OH)3难溶于水,因此可以用向煮沸的氢氧化钠溶液中滴加饱和三氯化铁溶液的方法制备氢氧化铁胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com