
ЁОЬтФПЁПдкУмБеШнЦїжаНјааЗДгІCH4(g)+H2O(g) ![]() CO(g)+3H2(g)ЁЁ ЁїH>0ЃЌВтЕУc(CH4)ЫцЗДгІЪБМф(t)ЕФБфЛЏШчЭМЫљЪОЁЃЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
CO(g)+3H2(g)ЁЁ ЁїH>0ЃЌВтЕУc(CH4)ЫцЗДгІЪБМф(t)ЕФБфЛЏШчЭМЫљЪОЁЃЯТСаХаЖЯе§ШЗЕФЪЧЃЈ ЃЉ
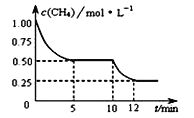
A. 10 minЪБЃЌИФБфЕФЭтНчЬѕМўПЩФмЪЧЩ§ИпЮТЖШ
B. ЗДгІНјааЕН12minЪБЃЌCH4ЕФзЊЛЏТЪЮЊ25%
C. 0Ёз5 minФкЃЌv(H2)ЃН0.1 molЁЄ(LЁЄmin)-1
D. КуЮТЯТЃЌЫѕаЁШнЦїЬхЛ§ЃЌЦНКтКѓH2ХЈЖШМѕаЁ
ЁОД№АИЁПA
ЁОНтЮіЁП
A. гЩЭМПЩжЊЃЌ10min ЪБМзЭщЕФХЈЖШМЬајМѕаЁЃЌИУЗДгІЯђе§ЗДгІЗНЯђвЦЖЏЃЌИУЗДгІе§ЗДгІЪЧЮќШШЗДгІЃЌПЩФмЪЧЩ§ИпЮТЖШЃЌЙЪAе§ШЗЃЛ
B. ЗДгІНјааЕН12minЪБЃЌCH4ЕФзЊЛЏТЪЮЊ![]() ЁС100ЃЅ=75ЃЅЃЌЙЪBДэЮѓЃЛ
ЁС100ЃЅ=75ЃЅЃЌЙЪBДэЮѓЃЛ
C. ИљОнЭМПЩжЊЃЌЧА5minФкМзЭщЕФХЈЖШгЩ1.00mol/ LМѕаЁЮЊ0.50mol/LЃЌЙЪv(CH4) =(1-0.5)molL-1/5min=0.1mol/ (Lmin) ЃЌгЩЛЏбЇМЦСПЪ§жЎБШЕШгкЗДгІЫйТЪжЎБШЃЌдђv (H2)=3ЁС0.1mol/ (Lmin) =0. 3mol/(Lmin) ЃЌЙЪCДэЮѓЃЛ
D. КуЮТЯТЃЌЫѕаЁШнЦїЬхЛ§ЕМжТЧтЦјХЈЖШдіДѓЃЌЫфШЛбЙЧПдіДѓЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌвЦЖЏЕФНсЙћМѕаЁЧтЦјХЈЖШЕФдіДѓЃЌЕЋИљОнРеЯФЬиСадРэЃЌВЛЛсЯћГ§ХЈЖШдіДѓЃЌЦНКтКѓc (H2)діДѓЃЌЙЪDДэЮѓЃЛ
ЙЪбЁAЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCO2зЪдДЛЏРћгУЕФЗНЗЈжЎвЛЪЧКЯГЩЖўМзУбЃЈCH3OCH3ЃЉЁЃ
ЃЈ1ЃЉCO2 ДпЛЏМгЧтКЯГЩЖўМзУбЕФЙ§ГЬжажївЊЗЂЩњЯТСаЗДгІЃКЗДгІIЃКCO2(g) + H2(g) ![]() CO(g) + H2O(g) H= +41.2 kJmol-1;ЗДгІII: 2CO2(g) + 6H2(g)
CO(g) + H2O(g) H= +41.2 kJmol-1;ЗДгІII: 2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;ЦфжаЃЌЗДгІII ЗжвдЯТЂйЂкСНВНЭъГЩЃЌЧыаДГіЗДгІЂйЕФШШЛЏбЇЗНГЬЪНЁЃ
CH3OCH3(g) + 3H2O(g) H = - 122.5 kJmol-1;ЦфжаЃЌЗДгІII ЗжвдЯТЂйЂкСНВНЭъГЩЃЌЧыаДГіЗДгІЂйЕФШШЛЏбЇЗНГЬЪНЁЃ
Ђй _____
Ђк2 CH3OH(g) ![]() CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
CH3OCH3(g) + H2O(g) H = -23.5 kJmol-1
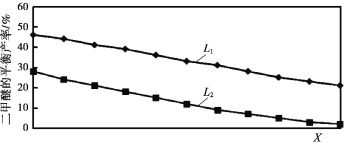
ЃЈ2ЃЉLЃЈL1ЁЂL2ЃЉЁЂXЗжБ№ДњБэбЙЧПЛђЮТЖШЃЌШчЭМБэЪОLвЛЖЈЪБЃЌЗДгІIIжаЖўМзУбЕФЦНКтВњТЪЫцXБфЛЏЕФЙиЯЕЃЌЦфжаXДњБэЕФЮяРэСПЪЧ_____ЁЃХаЖЯL1ЁЂL2ЕФДѓаЁЃЌВЂМђЪіРэгЩЃК_____ЁЃ
ЃЈ3ЃЉКубЙЪБЃЌдкCO2КЭH2Ц№ЪМСПвЛЖЈЕФЬѕМўЯТЃЌCO2ЦНКтзЊЛЏТЪКЭЦНКтЪБCH3OCH3ЕФбЁдёад![]() ЃЉЫцЮТЖШБфЛЏШчЭМЁЃ
ЃЉЫцЮТЖШБфЛЏШчЭМЁЃ
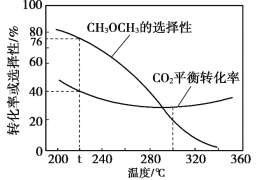
Ђйt Ёц ЪБЃЌЦ№ЪМЭЖШыa molCO2ЃЌb mol H2ЃЌДяЕНЦНКтЪБЗДгІIIЯћКФЕФH2ЕФЮяжЪЕФСПЮЊ______molЁЃ
ЂкЮТЖШИпгк300ЁцЃЌCO2ЦНКтзЊЛЏТЪЫцЮТЖШЩ§ИпЖјдіДѓЕФдвђЪЧ______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЫљЪОЪЧВПЗжЖЬжмЦкдЊЫидзгАыОЖгыдзгађЪ§ЕФЙиЯЕЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
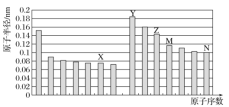
A.ZЁЂNСНжждЊЫиаЮГЩЕФЛЏКЯЮяЪЧРызгЛЏКЯЮя
B.ЭЈЙ§MЁЂNКЌбѕЫсЕФЫсадЧПШѕЃЌПЩвдБШНЯСНепЕФЗЧН№Ъєад
C.ZЕФбѕЛЏЮяФмЗжБ№ШмНтгкYЕФЧтбѕЛЏЮяКЭNЕФЧтЛЏЮяЕФЫЎШмвКжа
D.гЩXгыMСНжждЊЫизщГЩЕФЛЏКЯЮяФмгыЫЎЗДгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаБэИёжаЕФИїжжЧщПіЃЌПЩвдгУгвЭМЕФЧњЯпБэЪОЕФЪЧ ЃЈ ЃЉ
ЗДЁЁЁЁ гІ | знзјБъ | Мз | вв | |
A | ЯрЭЌжЪСПЕФАБЃЌдкЭЌвЛШнЦїжа | АБЦјЕФзЊЛЏТЪ | 500Ёц | 400Ёц |
B | ЕШжЪСПМиЁЂФЦЗжБ№гызуСПЫЎЗДгІ | H2жЪСП | ФЦ | Ми |
C | дкЬхЛ§ПЩБфЕФКубЙШнЦїжаЃЌЬхЛ§БШ1ЉU3ЕФN2ЁЂH2ЃЌ | АБЦјЕФХЈЖШ | ЛюадИпЕФДпЛЏМС | ЛюадвЛАуЕФДпЛЏМС |
D | 2 molSO2КЭ1 molO2ЃЌдкЯрЭЌЮТЖШЯТ2SO2+ O2 | SO3ЮяжЪЕФСП | 2ИіДѓЦјбЙ | 10ИіДѓЦјбЙ |
A. AB. BC. CD. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
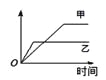
ЁОЬтФПЁПЙигкЯТСаЭМЯѓЫЕЗЈе§ШЗЕФЪЧ
A. ЂйБэЪОЛЏбЇЗДгІ2NO2(g) + O3(g) = N2O5(g) + O2(g) ІЄH > 0
B. ЂкБэЪО25ЁцЪБЃЌгУ0.1 mol/L CH3COOHШмвКЕЮЖЈ20 mL 0.1 mol/L NaOHШмвКЃЌШмвКЕФpHЫцМгШыЫсЬхЛ§ЕФБфЛЏ
C. ЂлБэЪО10 mL 0.01 mol/LЫсадKMnO4ШмвКгыЙ§СПЕФ0.1 mol/L H2C2O4ШмвКЛьКЯЪБЃЌ n (Mn2+) ЫцЪБМфЕФБфЛЏ
D. ЂмПЩБэЪОЯђЯЁСђЫсШмвКжаЕЮМгЧтбѕЛЏБЕШмвКЃЌШмвКЕМЕчадЫцЧтбѕЛЏБЕЮяжЪЕФСПЕФБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњПЦбаШЫдБЬсГіСЫгЩCO2КЭCH4зЊЛЏЮЊИпИНМгжЕВњЦЗCH3COOHЕФДпЛЏЗДгІРњГЬЁЃИУРњГЬЪОвтЭМШчЯТЁЃ

ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. ЩњГЩCH3COOHзмЗДгІЕФдзгРћгУТЪЮЊ100%
B. CH4ЁњCH3COOHЙ§ГЬжаЃЌгаCЈDHМќЗЂЩњЖЯСб
C. ЂйЁњЂкЗХГіФмСПВЂаЮГЩСЫCЈDCМќ
D. ИУДпЛЏМСПЩгааЇЬсИпЗДгІЮяЕФЦНКтзЊЛЏТЪ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчНтжЪЕФЫЎШмвКжаДцдкЕчРыЦНКтЁЃ
ЃЈ1ЃЉДзЫсЪЧГЃМћЕФШѕЫсЁЃ
ЂйДзЫсдкЫЎШмвКжаЕФЕчРыЗНГЬЪНЮЊ____________ЁЃ
ЂкЯТСаЗНЗЈжаЃЌПЩвдЪЙДзЫсШмвКжаCH3COOHЕчРыГЬЖШдіДѓЕФЪЧ_______ЃЈЬюзжФИађКХЃЉЁЃ
a ЕЮМгЩйСПХЈбЮЫс b ЮЂШШШмвК
c МгЫЎЯЁЪЭ d МгШыЩйСПДзЫсФЦОЇЬх
ЃЈ2ЃЉгУ0.1 molЁЄL-1 NaOHШмвКЗжБ№ЕЮЖЈЬхЛ§ОљЮЊ20mLЁЂХЈЖШОљЮЊ0.1 molЁЄL-1ЕФбЮЫсКЭДзЫсШмвКЃЌЕУЕНЕЮЖЈЙ§ГЬжаШмвКpHЫцМгШыNaOHШмвКЬхЛ§ЖјБфЛЏЕФСНЬѕЕЮЖЈЧњЯпЁЃ
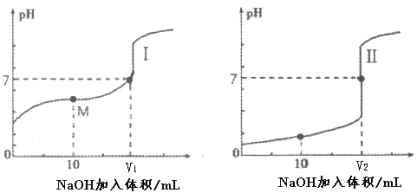
ЂйЕЮЖЈДзЫсЕФЧњЯпЪЧ___________ЃЈЬюЁАIЁБЛђЁАЂђЁБЃЉЁЃ
ЂкЕЮЖЈПЊЪМЧАЃЌ0.1 molЁЄL-1 NaOHЁЂ0.1 molЁЄL-1ЕФбЮЫсКЭ0.1 molЁЄL-1ДзЫсШ§жжШмвКжагЩЫЎЕчРыГіЕФc(H+)зюДѓЕФЪЧ_______ШмвКЁЃ
ЂлЭМIжаЃЌV=10ЪБЃЌШмвКжаЕФc(H+)_________c(OH-) ЃЈЬюЁА>ЁБЁЂЁАЃНЁБЛђЁА<ЁБЃЌЯТЭЌЃЉЃЌc(Na+)_________c(CH3COO-)ЁЃ
ЃЈ3ЃЉЯТБэЮЊФГЭЌбЇЫљВт25ЁцЪБЃЌМзЁЂввСНжжШмвКЕФpHЁЃ
Мз | вв | |
pH | 11 | 11 |
ШмвК | АБЫЎ | ЧтбѕЛЏФЦШмвК |
ЂйМзШмвКжаЕФc(OH-) =___________mol/LЁЃ
Ђк25ЁцЪБЃЌЕШЬхЛ§ЕФМзЁЂввСНШмвКгыЕШХЈЖШЕФбЮЫсЗДгІЃЌЯћКФЕФбЮЫсЬхЛ§ЃКМз_____ввЁЃ
ЂлМзЁЂввШмвКОљМгЫЎЯЁЪЭ10БЖКѓЃЌЫљЕУШмвКЕФpHЃКМз_____ввЁЃ
ЃЈ4ЃЉУКЬПЙЄвЕжаОГЃЛсВњЩњДѓСПSO2ЃЌЮЊЗРжЙЮлШОЛЗОГЃЌГЃВЩгУЮќЪеЗЈНјааДІРэЁЃвдЯТЮяжЪПЩгУгкЮќЪеSO2ЕФЪЧ____________ЁЃ
A H2O2 B Na2CO3 C Na2SO3 D Ca(OH)2
ЃЈ5ЃЉЯТБэЪЧМИжжГЃМћШѕЫсЕФЕчРыГЃЪ§
ЛЏбЇЪН | CH3COOH | H2SO3 | HClO | H2CO3 |
ЕчРы ГЃЪ§ | 1.8ЁС10-5 | K1=1.23ЁС10-2 K2=6.6ЁС10-8 | 3.0ЁС10-8 | K1=4.4ЁС10-7 K2=4.7ЁС10-11 |
/span>
вдЯТЗДгІЖдгІЕФРызгЗНГЬЪНе§ШЗЕФЪЧ___________ЁЃ
A Na2CO3ШмвКЮќЪеЩйСПSO2ЃКCO32-+SO2+H2O = SO32-+HCO3-
B ЦЏАзвКЩњаЇЕФдРэЃКClO-+CO2+H2O = HClO+HCO3-
C ДЮТШЫсФЦШмвКЮќЪеЩйСПSO2ЃКClO-+SO2+H2O = HClO+SO32-
D ДзЫсГ§ЫЎЙИжаЕФCaCO3ЃК2CH3COOH+CaCO3 = Ca2++2CH3COO-+H2O+CO2Ёќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПWЁЂMЁЂXЁЂYЁЂZЪЧжмЦкБэЧА36КХдЊЫижаЕФЫФжжГЃМћдЊЫиЃЌЦфдзгађЪ§вРДЮдіДѓЁЃWЕФвЛжжКЫЫидкПМЙХЪБГЃгУРДМјЖЈвЛаЉЮФЮяЕФФъДњЃЛMЕФбѕЛЏЮяЪЧЕМжТЫсгъЕФжївЊЮяжЪжЎвЛЁЃXЕФФГвЛжжЕЅжЪдкИпПеДѓЦјВужаБЃЛЄШЫРрУтдтЬЋбєЙтжазЯЭтЯпЕФЧПСвЧжЯЎЃЛYЕФЛљЬЌдзгКЫЭтга6ИідзгЙьЕРДІгкАыГфТњзДЬЌЃЛZФмаЮГЩКьЩЋЕФZ2OКЭКкЩЋЕФZOСНжжбѕЛЏЮяЁЃ
(1)Y3ЃЋЛљЬЌЕчзгХХВМЪНПЩБэЪОЮЊ________ЁЃ
(2)MX![]() ЕФПеМфЙЙаЭЪЧ________(гУЮФзжУшЪі)ЁЃ
ЕФПеМфЙЙаЭЪЧ________(гУЮФзжУшЪі)ЁЃ
(3)MПЩаЮГЩЖржжЧтЛЏЮяЃЌЦфжаMH3ЕФМюадЧПгкM2H4ЕФдвђЪЧ_________________________________ЁЃ
(4)ИљОнЕШЕчзгдРэЃЌWXЗжзгЕФНсЙЙЪНЮЊ________ЁЃ
(5)1 mol WX2жаКЌгаЕФІвМќЪ§ФПЮЊ________ЁЃ
(6)H2XЗжзгжаXдзгЙьЕРЕФдгЛЏРраЭЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЛњЗДгІжаЃЌВЛЪєгкШЁДњЗДгІЕФЪЧЃЈ ЃЉ
A. ![]() +Cl2
+Cl2![]() +HCl
+HCl
B. CH2=CH2 + Br2 ЁњCH2BrCH2Br
C. ClCH2CH2CH3+NaOH![]() HOCH2CH2CH3+NaCl
HOCH2CH2CH3+NaCl
D. ![]() +HO-NO2
+HO-NO2![]() +H2O
+H2O
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com