
【题目】含有相同氧原子数的二氧化硫和三氧化硫,物质的量之比是___,质量之比是___。把4mol/LCuSO4和2mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和),求混合溶液中C(CuSO4)=_____mol/L,C(SO42-)=___mol/L。将10毫升2mol/L的硫酸溶液加水稀释到0.5mol/L,其体积为____毫升。
【答案】3:2 6:5 2 3 40
【解析】
含有相同氧原子数的SO2和SO3,分子数之比为3:2,由n=![]() 可知,物质的量之比为3:2,则质量之比为3×64:2×80=6:5;把4mol/LCuSO4和2mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和),假设体积为1L,则混合后含有硫酸铜的物质的量为:4mol/L×1L=4mol,含有硫酸的物质的量为:2mol/L×1L=2mol,则混合液中硫酸铜的物质的量c=
可知,物质的量之比为3:2,则质量之比为3×64:2×80=6:5;把4mol/LCuSO4和2mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于混合前溶液的体积之和),假设体积为1L,则混合后含有硫酸铜的物质的量为:4mol/L×1L=4mol,含有硫酸的物质的量为:2mol/L×1L=2mol,则混合液中硫酸铜的物质的量c=![]() =2mol/L,硫酸根离子的物质的量浓度c=
=2mol/L,硫酸根离子的物质的量浓度c=![]() =3mol/L,将10毫升2mol/L的硫酸溶液加水稀释到0.5mol/L,设其体积为V,则依据溶液稀释过程中溶质的物质的量不变得:2mol/L×10mL=0.5mol/L×V,解得V=40mL;
=3mol/L,将10毫升2mol/L的硫酸溶液加水稀释到0.5mol/L,设其体积为V,则依据溶液稀释过程中溶质的物质的量不变得:2mol/L×10mL=0.5mol/L×V,解得V=40mL;
故答案为:3:2;6:5;2;3;40。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | NaOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2。实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花;将干燥的锡花加入反应器中,再向反应器中缓慢地通入干燥的氯气。(装置C中的试剂Ⅹ未画出)
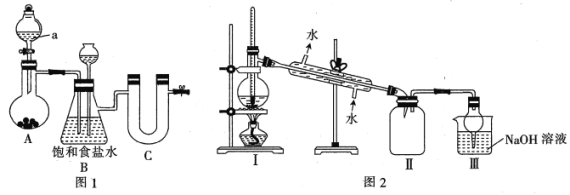
I.图1为实验室制备干燥氯气的实验装置(夹持装置已略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO2]和浓盐酸,A中发生反应的化学方程式为_________________________________。
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有___________作用。
(3)试剂Ⅹ可能为___________(填标号)。
A.无水氯化钙 B.浓硫酸 C.五氧化二磷 D.碱石灰
(4)用锡花代替锡粒的目的是_________________________________。
(5)四氯化锡在潮湿空气中水解的化学方程式为_________________________________。
Ⅱ.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是____________________、______________________。
(7)实验用的锡花中含有金属铜。某同学设计下列实验测定锡花的纯度:
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用0.9500mol·L-1的K2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为Fe2++Cr2O72-+H+→Cr3++Fe3++H2O(未配平)
若达到滴定终点时共消耗21.00mLK2Cr2O7溶液,试计算锡花中锡的百分含量:___________(结果保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mLNaOH溶液中逐滴加入0.lmol/L的HR溶液,测得反应混合液中c水(OH-)与V(HR)的变化关系如图所示。下列说法不正确的是
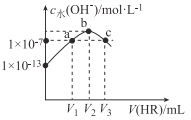
A. V2=10
B. HR为弱酸
C. 当V(HR)=V2时,溶液中存在:c (OH-)-c(H+)=c(HR)
D. 当V(HR)=V1或V3时,溶液中均有:c(Na+)=c(HR)+c(R-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为______mol.
(2)该气体所含原子总数为______个.
(3)该气体在标准状况下的体积为______L.
(4)该气体溶于1L水中(不考虑反应),形成的溶液溶质的质量分数为______.
(5)该气体溶于水形成VL溶液,其溶液的物质的量浓度为______mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,燃煤脱硫是科研工作者研究的重要课题之一,主要脱硫方法有以下几种:
Ⅰ.石灰法原理为:2CaO(s)+2SO2(g)+O2(g)2CaSO4(s)
(1)T1℃时,向10L恒容密闭容器中加入3molCaO(s),并通入2molSO2(g)和1molO2(g)发生上述反应,2min时达平衡,此时CaSO4(s)为1.8mol。0~2min内,用SO2(g)表示的该反应的速率v(SO2)=__________________________。
Ⅱ.催化氧化法
活性炭催化氧化法是基于活性良好的物理吸附和化学吸附作用,其反应机理为:
O2+2C→2C—O;SO2+C→C—SO2;C—SO2+C—O→C—SO3+C;
C—SO3+H2O→C—H2SO4;C—H2SO4→H2SO4+C。
(2)整个过程中总的化学反应方程式为__________________________________________。
(3)活性炭在反应过程中作催化剂,改变了_____________(填选项字母)。
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能
Ⅲ.CO还原法原理为2CO(g)+SO2(g)S(g)+2CO2(g) ΔH
已知:S(g)+O2(g)=SO2(g) ΔH1=-574.0kJ·mol-1;CO燃烧热为283.0kJ·mol-1。
(4)起始温度为T2℃时,分别在三个容积均为10L的绝热密闭容器中,发生反应2CO(g)+SO2(g)S(g)+2CO2(g),测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | A |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
①容器乙达到平衡后,保持其他条件不变,再向其中充入CO(g)、 SO2(g)、S(g)、CO2(g)各1mol,此时v(正)__________ v(逆)。(填“>”、“<”或“=”)。
②下列判断正确的是________________(填选项字母)。
A.b=1.6 B.平衡常数甲>乙 C.达到平衡的时间:丙<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应:2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2mol SO2 1molO2 | 4mol SO3 | 2molSO2 1mol O2 |
平衡v正(SO2) mol/(L·s) | v1 | v2 | v3 |
平衡c(SO3) mol/L | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | a1(SO2) | a2(SO3) | a3(SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法不正确的是
A. v1< v2,c2< 2c1 B. v1< v3,α1(SO2 ) >α3(SO2 )
C. K1> K3,p2> 2p3 D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com