
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.1mol H2O2完全分解产生O2时,转移的电子数为2 NA
B.0. lmol 环氧乙烷(![]() ) 中含有的共价键数为0. 3 NA
) 中含有的共价键数为0. 3 NA
C.常温下,1L pH= l 的草酸 ( H2C2O4 ) 溶液中H+ 的数目为0. 1NA
D.1mol淀粉水解后产生的葡萄糖分子数目为NA
【答案】C
【解析】
A.H2O2分解的方程式为2H2O2=2H2O+O2↑,H2O2中O元素的化合价部分由-1价升至0价、部分由-1价降至-2价,1molH2O2完全分解时转移1mol电子,转移电子数为NA,A错误;
B.1个环氧乙烷中含4个C—H键、1个C—C键和2个C—O键,1mol环氧乙烷中含7mol共价键,0.1mol环氧乙烷中含0.7mol共价键,含共价键数为0.7NA,B错误;
C.pH=1的草酸溶液中c(H+)=0.1mol/L,1L该溶液中含H+物质的量n(H+)=0.1mol/L×1L=0.1mol,含H+数为0.1NA,C正确;
D.淀粉水解的方程式为![]() ,1mol淀粉水解生成nmol葡萄糖,生成葡萄糖分子数目为nNA,D错误;
,1mol淀粉水解生成nmol葡萄糖,生成葡萄糖分子数目为nNA,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】氮氧化物(主要为NO和NO2)是大气污染物,如何有效地消除氮氧化物的污染是目前科学家们研究的热点问题。
(1)用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。
①尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为___。用尿素溶液也可吸收氮氧化物,研究表明,当混合气体中![]() =1时,总氮还原率最高,随着,
=1时,总氮还原率最高,随着,![]() 比值增大,总氮还原率降低的主要原因是___。
比值增大,总氮还原率降低的主要原因是___。
②在一个体积为1L的恒容密闭容器中充入1molCO2和1molNH3,在恒定温度下使其发生反应2NH3(g)+CO2(g)![]() NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
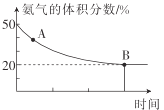
则A点时v正(CO2)___(填“>”“<”或“=”)B点时v正(CO2),原因是___。B点时,NH3的转化率为___。
③下列有关反应2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)的说法正确的是___。
CO(NH2)2(s)+H2O(g)的说法正确的是___。
A.分离出少量的尿素,NH3的转化率将增大
B.反应达到平衡时,降低反应体系的温度,CO2的浓度减小
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高尿素的产率
(2)已知O3氧化氮氧化物的主要反应的热化学方程式如下:
2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
则反应4NO2(g)+O2(g)=2N2O5(g)△H=___(用含a、b、c的代数式表示)kJ·mol-1。
(3)氮氧化物也可用碱液吸收。若NO和NO2的混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为___;已知常温下Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq)![]() NaNO2(aq)+H2O(l)的平衡常数K=___。
NaNO2(aq)+H2O(l)的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:xA(g)+yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度0.30mol/L。下列有关判断正确的是( )
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度0.30mol/L。下列有关判断正确的是( )
A.x+y<z
B.平衡向正反应方向移动
C.A的转化率降低
D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能是指处于基态的气态原子失去一个电子,生成+1价气态阳离子所需要的能量。如图是部分元素的第一电离能I1随原子序数变化的曲线图。
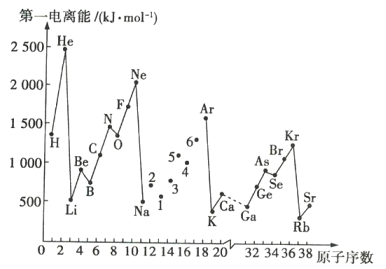
请回答下列问题:
(1)分析图中同周期元素第一电离能的变化规律,将Na~Ar之间1~6号元素用短线连接起来,构成完整的图象___。
(2)根据图分析可知,同主族元素的第一电离能的变化规律是___。
(3)图中5号元素在元素周期表中的位置是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰在锰系产品中具有重要地位,由软锰矿(MnO2) 和硫铁矿(FeS2)制备流程如下:

(1)从“除质2”后的溶液中得到MnSO4的操作为______、降温结晶、过滤和干燥。
(2)下图是在一定条件下,不同浓度的硫酸对各元素浸出率的影响,由此得出的相关结论是:

①__________;②__________。提高软锰矿浸出率的措施还有______和_______。
(3)除铁剂为H2SO5和氨水。
①H2SO5 中S的化合价为+6,其中过氧键的数目为______,加入其目的是_________。
②写出Fe3+生成沉淀黄铵铁矾NH4Fe3(SO4)2(OH)6的离子方程式____________。
(4)工业除质剂为MnF2,发生反应为(已知,该温度下MnF2、CaF2 和MgF2 的Ksp分别为5.0×10-3、2.0×10-10、8.0×10-11)
反应I:MnF2(s) +Ca2+=CaF2(s) +Mn2+
反应II:MnF2(s) +Mg2+=MgF2(s) + Mn2+
若滤液中c(Mg2+) =0.02 mol/L,加入MnF2(s),使Ca2+恰好沉淀完全即溶液中c(Ca2+) =1.0×10-5mol/L,此时是否有MgF2 沉淀生成?_________(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z的原子序数依次增大,W 在大气中有两种同素异形体且均能支持燃烧,X 的原子半径是所有短周期主族元素中最大的,非金属元素 Y 的原 子序数是 Z 的最外层电子数的 2 倍。下列叙述不正确的是
A.Y、Z的氢化物稳定性 Y> Z
B.Y单质的熔点高于X 单质
C.X、W、Z 能形成具有强氧化性的 XZW
D.YZ4分子中 Y 和 Z 都 满足8 电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“异丙苯氧化法”生产丙酮和苯酚的合成路线如下,各反应的原子利用率均为100%。下列说法正确的是
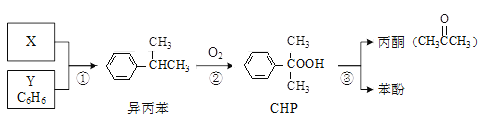
A. X的分子式为C3H8B. Y与异丙苯可用酸性KMnO4溶液鉴别
C. CHP与CH3COOH含有相同的官能团D. 可以用分液的方法分离苯酚和丙酮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)![]() 中含有的官能团为__。
中含有的官能团为__。
(2)CH2=CH-CH3加聚产物的结构简式是___。
(3)键线式![]() 表示的分子式__;
表示的分子式__;
(4)有机物(CH3)3CCH2CH(C2H5)CH3其系统命名法名称应为___。
(5)在下列有机物①CH3CH2CH3;②CH3-CH=CH2;③CH3-C![]() CH;④
CH;④![]() ;⑤(CH3)2CHCH3;⑥
;⑤(CH3)2CHCH3;⑥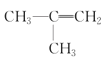 ;⑦
;⑦![]() ;⑧
;⑧![]() ;⑨
;⑨![]() ,⑩CH3CH2Cl中,属于饱和烃的是__,互为同系物的是__,互为同分异构体的是__。(填写序号)
,⑩CH3CH2Cl中,属于饱和烃的是__,互为同系物的是__,互为同分异构体的是__。(填写序号)
(6)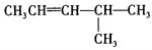 的系统命名法名称是 ___;
的系统命名法名称是 ___;
(7)3,4,4—三甲基—1—戊炔的结构简式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素的原子序数依次增大,A 的一种核素在考古时常用来鉴定一些文物的年代,B的气态氢化物的水溶液呈碱性;C为金属元素且有两种常见含氧化合物(都含两种元素);若往D单质的水溶液中滴加少量紫色石蕊溶液,可观察到先变红后褪色。下列说法中正确的是( )
A.C的两种含氧化合物中阴、阳离子个数比都为1∶2
B.最高价氧化物对应的水化物的酸性:B>D
C.B的氢化物的沸点一定高于A的氢化物
D.电负性:D>B>A>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com