
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”),Ts的原子核外最外层电子数是7。下列叙述不正确的是
”),Ts的原子核外最外层电子数是7。下列叙述不正确的是
A.Ts是第七周期第ⅥIA族元素
B.Ts的同位素原子具有相同的电子数
C.HTs易溶于水,稳定性强,还原性强
D.Ts在同族元素中非金属性最弱
科目:高中化学 来源: 题型:
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池放电时,发生还原反应的物质是________;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的_____ (填“正”或“负”)极相连。
(3)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 |
①实验操作I的名称________ 则加入H2O2的目的是____________________。
②乙同学认为应将方案中的pH调节到8,你认为此观点_____(填“正确”或“不正确”),理由是_________。
(4)该蓄电池充电时阴极的电极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有CO32-、SO42-、SO32-、Fe2+、Fe3+、NH4+、Ba2+中的三种离子,实验小组为确定其化学式做了如下实验:
①准确称取6.125g样品,配制成250.00mL溶液X。
②取20.00mL溶液X,加入足量盐酸,无明显现象;再加足量BaCl2溶液,产生白色沉淀;将沉淀过滤、洗涤、干燥至恒重,得白色固体0.5825g。
③取20.00mL溶液X,加入适量稀硫酸酸化后,用0.01000mol·L-1KMnO4溶液滴定至终点,重复滴定三次,测得消耗KMnO4溶液体积的平均值为25.00mL。
④设计如图所示的装置,取20.00mL溶液Ⅹ进行实验,实验前后B装置增重0.04250g。
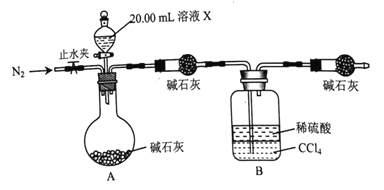
⑤取少量溶液X,滴加0.1 mol ·L-1 KSCN溶液无明显现象,再向其中滴加0.1mol·L-1AgNO3溶液,有白色沉淀生成。
回答下列问题;
(1)完成实验①所需要的玻璃仪器有;烧杯、玻璃棒、量筒、____________________。
(2)实验③达到滴定终点的现象是________________________________________。
(3)实验④的反应结束后,打开止水夹通入N2的作用是_________________________。
(4)根据以上实验数据计算该结晶水合物的化学式为_________________________。
(5)某同学查阅资料发现 AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了如图实验装置并进行下列实验。
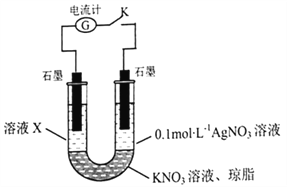
先断开电键K,向溶液X中滴加0.1 mol ·L-1 KSCN溶液,无明显现象,说明_____________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____________,溶液变红的原因是___________(用离子方程式表示),该实验设计的优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的有
A.向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:
Ca2++2ClO- +2H2O+2SO2= CaSO4↓+2Cl- +4H++SO42-
B.向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-![]() SO2↑+Cu2++2H2O
SO2↑+Cu2++2H2O
C.向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+ OH-![]() H2O +CO32-
H2O +CO32-
D.用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH![]() Na2SiO3+H2O
Na2SiO3+H2O
B. 在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+ H2O2+2H+= I2+O2↑+2H2O
C. 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+ 4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
D. “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用放出氯气:ClO-+ Cl-+ 2H+= Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质一定属于同系物的是( )
①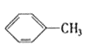 ②
②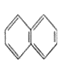 ③
③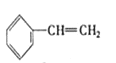 ④C2H4 ⑤CH2=CH-CH=CH2⑥C3H6⑦
④C2H4 ⑤CH2=CH-CH=CH2⑥C3H6⑦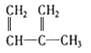 ⑧
⑧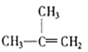
A. ④和⑧B. ①和③C. ⑤、⑦和⑧D. ④、⑥和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,含氮元素的物质可发生如图所示的循环转化。

回答下列问题:
(1)氮的原子结构示意图为_________。
(2)图中属于“氮的固定”的是_________(填字母,下同);转化过程中发生非氧化还原反应的是_________。
(3)若“反应h”是在NO2与H2O的作用下实现,则该反应中氧化产物与还原产物的物质的量之比为_________。
(4)若“反应i”是在酸性条件下由NO3-与Zn的作用实现,则该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素基态原子电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5.则下列有关比较中正确的是
A. 单电子数:③>① B. 原子半径:④>③
C. 电负性:②>① D. 最高正化合价:④>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Phenolphthalein是常用酸碱指示剂,其结构如图所示。有关该有机物说法正确的是
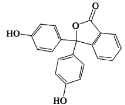
A.分子式为C20H12O4
B.含有的官能团有羟基、酯基、羧基
C.可以发生取代反应、加成反应和氧化反应
D.1mol该物质与H2和溴水反应,消耗H2和Br2的最大值分别为10mol和4mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com