
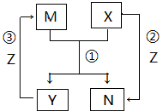
 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )| A. | 该过程所涉及的反应均为氧化还原反应 | |
| B. | 当X单质为金属时,可能是Na或Fe | |
| C. | 当X单质为非金属时,X可以是 碳 | |
| D. | 反应①一定是氧化还原反应 |
分析 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,反应①M+X=Y+N为置换反应,反应②X+Z=N,反应③为Y+Z=M是化合反应,其中M在常温下为液态,推断为水,转化关系如:X可以为C,Y为H2,N为CO,Z为O2,
A.分析可知反应中都存在单质参加或单质生成,反应过程中有元素化合价变化;
B.若X为钠其中反应②不能实现;
C.当X单质为非金属时,可以是C;
D.反应①是置换反应.
解答 解:X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,反应①M+X=Y+N为置换反应,反应②X+Z=N,反应③为Y+Z=M是化合反应,其中M在常温下为液态,推断为水,转化关系如:X可以为C,Y为H2,N为CO,Z为O2,
A.分析可知反应中都存在单质参加或单质生成,反应过程中有元素化合价变化,该过程所涉及的反应均为氧化还原反应,故A正确;
B.若X为钠其中反应②不能实现,Na和氧气反应不能一步生成氢氧化钠,若为铁和水的反应生成四氧化三铁和氢气,可以满足反应关系实现,故B错误;
C.当X单质为非金属时,可以是C,反应①为C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,反应②为2C+O2=2CO,反应③为2H2+O2=2H2O,当X单质为非金属时,X可以是 碳,故C正确;
D.反应①是置换反应,一定为氧化还原反应,故D正确;
故选B.
点评 本题考查了无机推断、物质性质、反应类型和反应产物的分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 2A+B→2C+Q | B. | 2C→2A+B+Q | C. | 2A(g)+B(g)→2C(g)+Q | D. | 2A(g)+B(g)→2C(g)-Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,又知乙与DB2可进行反应,写出相应的化学方程式Na2O2+SO2=Na2SO4.
,又知乙与DB2可进行反应,写出相应的化学方程式Na2O2+SO2=Na2SO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;C
;C .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁原子的价电子数比铝少 | |
| B. | 镁遇冷浓硝酸和硫酸,表面不能钝化,而铝均能 | |
| C. | 镁带能在空气中和在盛CO2的集气瓶里燃烧,而铝箔均不能 | |
| D. | 铝的硬度、延展性、熔点均比镁大、好、高 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用NH4Cl与NaNO2溶液混合微热制N2 | |
| B. | SnCl4与水的反应:SnCl4+2H2O═SnO2+4HCl | |
| C. | 人工树叶制取甲烷:CO2+2H2O$\frac{\underline{\;\;\;\;\;\;\;光\;\;\;\;\;\;\;}}{人工树叶}$CH4+2O2 | |
| D. | 银针验毒:4Ag+2H2S+O2═2Ag2S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.
过氧化氢是重要的氧化剂和还原剂,常周于消毒、杀菌、漂白等.某化学兴趣小组同学.围绕着过氧化氢开展了调査研究与实验.| 实验编号 | T/X | H2O2初始浓度/moL•L-1 | FeCl3初始浓度/moL•L-1 |
| I | 20 | 1.0 | 0 |
| n | 50 | 1.0 | 0 |
| in | 50 | 1.0 | 0.1 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com